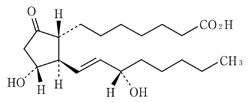
1
Sim, A. K. et al.:Arzneimittelforschung, 1986;36(8):1206-1209
2
名倉一晶他:基礎と臨床, 1986;20(10):5195-5205
3
江角凱夫他:基礎と臨床, 1986;20(9):4399-4428
プロスタグランジンE1 製剤
1筒 919円
有効成分 | 日局アルプロスタジル 5μg |
|---|---|
添加剤 | 精製ダイズ油 100mg 高度精製卵黄レシチン 18mg オレイン酸 2.4mg 濃グリセリン 22.1mg pH調節剤 |
有効成分 | 日局アルプロスタジル 10μg |
|---|---|
添加剤 | 精製ダイズ油 200mg 高度精製卵黄レシチン 36mg オレイン酸 4.8mg 濃グリセリン 44.2mg pH調節剤 |
| pH | 4.5~6.0 |
|---|---|
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 性状 | 白色の乳濁液で、わずかに粘性があり、特異なにおいがある |
| pH | 4.5~6.0 |
|---|---|
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 性状 | 白色の乳濁液で、わずかに粘性があり、特異なにおいがある |
効能又は効果 | 用法及び用量 |
慢性動脈閉塞症(バージャー病、閉塞性動脈硬化症) | 通常、成人1日1回1~2mL(アルプロスタジルとして5~10μg)をそのまま又は輸液に混和して緩徐に静注、又は点滴静注する。 なお、症状により適宜増減する。 |
進行性全身性硬化症 全身性エリテマトーデス | 通常、成人1日1回1~2mL(アルプロスタジルとして5~10μg)をそのまま又は輸液に混和して緩徐に静注、又は点滴静注する。 なお、症状により適宜増減する。 |
糖尿病における皮膚潰瘍 | 通常、成人1日1回1~2mL(アルプロスタジルとして5~10μg)をそのまま又は輸液に混和して緩徐に静注、又は点滴静注する。 なお、症状により適宜増減する。 |
振動病 | 通常、成人1日1回1~2mL(アルプロスタジルとして5~10μg)をそのまま又は輸液に混和して緩徐に静注、又は点滴静注する。 なお、症状により適宜増減する。 |
動脈管依存性先天性心疾患 | 輸液に混和し、開始時アルプロスタジル5ng/kg/minとして持続静注し、その後は症状に応じて適宜増減して有効最小量とする。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
抗凝血剤 ワルファリンカリウム等 | 出血傾向の増強をきたすおそれがある。 | 本剤は血小板凝集抑制作用を有するため、これらの薬剤との併用によりその作用を増強するおそれがある。 |
血小板機能を抑制する薬剤 アスピリン チクロピジン塩酸塩 シロスタゾール等 | 出血傾向の増強をきたすおそれがある。 | 本剤は血小板凝集抑制作用を有するため、これらの薬剤との併用によりその作用を増強するおそれがある。 |
血栓溶解剤 ウロキナーゼ等 | 出血傾向の増強をきたすおそれがある。 | 本剤は血小板凝集抑制作用を有するため、これらの薬剤との併用によりその作用を増強するおそれがある。 |
0.1~1%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|
消化器 | 嘔気 腹痛 嘔吐 下痢 腹部膨満感・不快感 | 食欲不振 便秘 口腔腫脹感 | 口内炎(アフタを含む) |
循環器 | 血圧降下注) 血管炎 顔面潮紅 胸部絞扼感注) | 発赤 胸痛注) 動悸 頻脈 | 血圧上昇注) |
呼吸器 | 咳嗽 呼吸困難 喘息注) | ||
血液 | 好酸球増多 | ||
中枢神経系 | 発熱 頭痛 | めまい 倦怠感 しびれ(感) | 悪寒 振戦 痙攣 |
皮膚 | 発疹 そう痒感 | 蕁麻疹 | 発汗 |
腎臓 | 腎不全の増悪注) | ||
注射部位 | 血管痛 発赤 | こわばり そう痒感 | |
出血傾向注) | 出血(鼻出血、眼底出血、結膜出血、皮下出血、血尿等) | ||
その他 | 熱感 | 四肢疼痛 (増強を含む) 気分不良 浮腫 視力低下 脱毛 | 低ナトリウム血症 四肢腫脹 |