1
東純一 他:医学と薬学 1989;22:365-381
2
Ahr, H.J. et al.:Arzneim-Forsch/Drug Res. 1989;39:1261-1267
3
五島雄一郎 他:医学のあゆみ 1989;149:591-618
4
坂本信夫 他:臨床と研究 1990;67:219-233
5
河盛隆造:薬理と治療 1996;24:837-852
6
豊田隆謙 他:薬理と治療 1996;24:639-657
7
豊田隆謙 他:薬理と治療 1996;24:1375-1392
8
河盛隆造:薬理と治療 1996;24:853-872
9
河盛隆造:薬理と治療 1996;24:1109-1129
10
Caspary, W.F. et al.:Res. Exp. Med. (Berl). 1979;175:1-6
11
末広逸夫 他:Clinica Chimica Acta. 1981;117:145-152
12
Azuma, J. et al.:In Kuhlmann J, Wingender W (eds.) Dose-Response Relationship of Drugs. W Zuckschwerdt Verlag. 1990;151-154
13
三村悟郎 他:医学と薬学 1987;18:1891-1898
14
早川哲夫 他:Nagoya J. Med. Sci. 1984;47:35-41
15
中埜幸治 他:糖尿病 1985;28:701-706
16
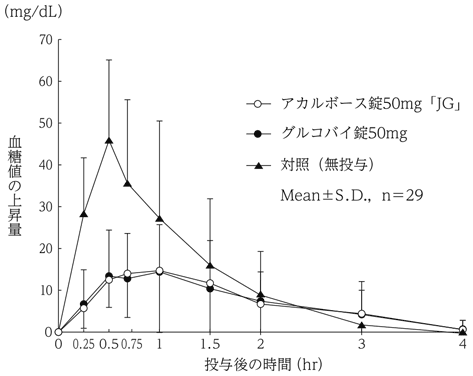
社内資料:生物学的同等性試験(錠50mg)
17
社内資料:生物学的同等性試験(錠100mg)