1
阿部真也ほか:周産期医学.2017;47:1353-1355 [20230027]
2
齊藤大祐ほか:鹿児島産科婦人科学会雑誌.2021;29:49-54 [20230028]
3
Sheps,S.G.et al.:Arch.Intern.Med.1997;157(21):2413-2446 [20003680]
4
Briggs,G.G.et al.:Ann.Pharmacother.2001;35(7-8):859-861 [20022566]
5
Cooper,W.O.et al.:N.Engl.J.Med.2006;354(23):2443-2451 [20180405]
6
Rai A,et al.: Am J Respir Crit Care Med.2016;193:A1890 [20220506]
7
Jansson PS,et al.: J Emerg Med.2018;55:836-40 [20220507]
8
Vadas P.: Am J Emerg Med.2020;38:1299.e1-2 [20220508]
9
Kane SP,et al.: Perfusion.2018;33:320-2 [20220509]
10
Pottegard,A,et al.: J.Intern.Med.2017;282(4):322-331 [20200004]
11
Pedersen,S.A,et al.: J.Am.Acad.Dermatol.2018;78(4):673-681 [20200005]
12
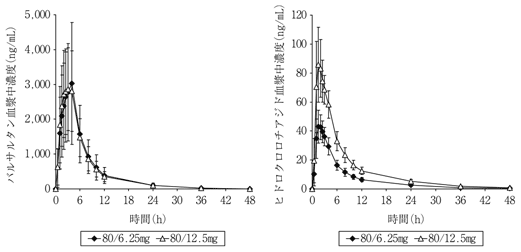
社内資料:配合剤投与時と単剤併用時の生物学的同等性の検討(2009年1月21日承認、CTD2.7.6-1.2.2) [20090179]
13
社内資料:薬物動態に対する食事の影響(2009年1月21日承認、CTD2.7.6-1.1.1) [20090181]
14
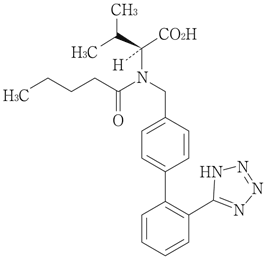
Colussi,D.M.et al.:J.Clin.Pharmacol.1997;37(3):214-221 [19992113]
15
Brunton,L.L.et al.:Goodman and Gilman’s,The Pharmacological Basis of Therapeutics,11th ed.2000;p1832 [20085278]
16
Waldmeier,F.et al.:Xenobiotica.1997;27(1):59-71 [19992107]
17
Nakashima,A.et al.:Xenobiotica.2005;35(6):589-602 [20055471]
18
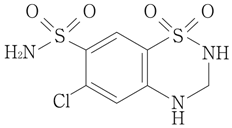
Beermann,B.et al.:Clin.Pharmacol.Ther.1976;19(5 Pt1):531-537 [19960040]
19
社内資料:バルサルタンとヒドロクロロチアジドの薬物間相互作用の検討(2009年1月21日承認、CTD2.7.6-3.1.1) [20090173]
20
川名正敏:新薬と臨牀.2009:58(4);583-596 [20091885]
21
社内資料:高血圧自然発症ラットを用いたバルサルタンとヒドロクロロチアジドの併用投与による降圧効果(2009年1月21日承認、CTD2.6.2-2.1.1) [20090177]