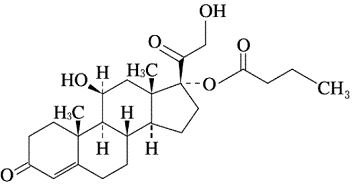
1
青山卓夫ほか:応用薬理.1974;8(7):1035-1047
2
竹田勇士ほか:西日本皮膚科.1974;36(1):24-30
3
石原 勝:薬理と治療.1975;3(6):1037-1047
外用副腎皮質ホルモン剤
1g 10.4円
有効成分 | (日局)ヒドロコルチゾン酪酸エステル(1g中) 1mg(0.1%) |
|---|---|
添加剤 | ステアリルアルコール、パラフィン、白色ワセリン |
有効成分 | (日局)ヒドロコルチゾン酪酸エステル(1g中) 1mg(0.1%) |
|---|---|
添加剤 | 無水クエン酸、クエン酸ナトリウム水和物、パラオキシ安息香酸メチル、セタノール、セトマクロゴール1000、白色ワセリン、流動パラフィン |
| 識別コード | TO-102V |
|---|---|
| 性状 | 白色~微黄色の全質均等の軟膏で、においはない。 |
| 識別コード | TO-102K |
|---|---|
| 性状 | 白色のクリームで、においはない。 本品1gに水3mLを加え激しく振り混ぜて得られる懸濁液のpHは3.5~4.0である。 |
0.1~5%未満 | 0.1%未満 | 頻度不明 | 注意・処置 | |
|---|---|---|---|---|
皮膚の感染症 | 真菌症(白癬等)、細菌感染症(毛嚢炎・せつ、汗疹等) | 真菌症(カンジダ症)、細菌感染症(伝染性膿痂疹)、ウイルス感染症 | 密封法(ODT)の場合に起こり易い。このような症状があらわれた場合には、適切な抗真菌剤、抗菌剤等を併用し、症状が速やかに改善しない場合には本剤の使用を中止すること。 | |
その他の皮膚症状 | ざ瘡様疹 | 酒さ様皮膚炎・口囲皮膚炎(ほほ、口囲等に潮紅、膿疱、丘疹、毛細血管拡張)、ステロイド皮膚(皮膚萎縮、毛細血管拡張、紫斑) | 特に長期連用に際しては注意すること。このような症状があらわれた場合には徐々にその使用を差し控え、副腎皮質ステロイドを含有しない薬剤に切り換えること。 | |
その他の皮膚症状 | 乾皮症様皮膚 | 接触皮膚炎、魚鱗癬様皮膚変化、多毛、色素脱失 | ||
過敏症 | 過敏症(発赤、そう痒感、刺激感、皮膚炎等) | |||
下垂体・副腎皮質系機能 | 下垂体・副腎皮質系機能の抑制 | 大量又は長期にわたる広範囲の使用、密封法(ODT)により、きたすことがある。 |
疾患名 | 有効率(%)(有効以上/評価症例数) | |||
軟膏 | クリーム | 計 | ||
湿疹・皮膚炎群 | 接触皮膚炎 | 90.8(59/65) | 81.1(30/37) | 87.3(89/102) |
アトピー性皮膚炎(乳児湿疹を含む) | 87.1(330/379) | 79.2(76/96) | 85.5(406/475) | |
神経皮膚炎(ビダール苔癬を含む) | 86.7(13/15) | 90.0(18/20) | 88.6(31/35) | |
脂漏性湿疹 | 81.8(27/33) | 87.1(81/93) | 85.7(108/126) | |
貨幣状湿疹 | 77.3(17/22) | 100(4/4) | 80.8(21/26) | |
急性湿疹 | 84.4(54/64) | 87.7(71/81) | 86.2(125/145) | |
慢性湿疹 | 78.9(30/38) | 71.1(32/45) | 74.7(62/83) | |
手の皮膚炎 | 41.7(25/60) | 67.9(38/56) | 54.3(63/116) | |
痒疹群 | 84.6(11/13) | 83.3(20/24) | 83.8(31/37) | |
尋常性乾癬 | 83.6(107/128) | 80.1(133/166) | 81.6(240/294) | |
掌蹠膿疱症 | 27.3(3/11) | 69.2(9/13) | 50.0(12/24) | |