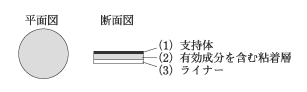
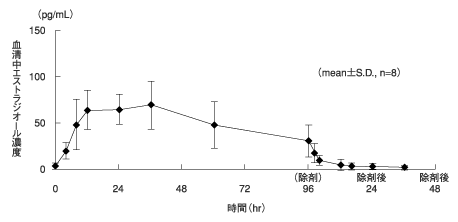
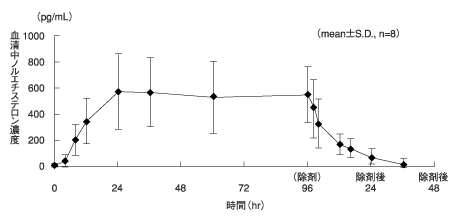
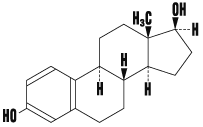
1
安田佳子 ほか: 医学のあゆみ 1976; 98(8): 537-8.
2
安田佳子 ほか: 医学のあゆみ 1976; 99(8): 611-2.
3
守隆夫: 医学のあゆみ 1975; 95(11): 599-602.
4
Grady D, et al.: Obstet Gynecol 1995; 85(2): 304-13.
5
Chlebowski RT, et al.: JAMA 2003; 289(24): 3243-53.
6
Anderson GL, et al.: JAMA 2004; 291(14): 1701-12.
7
Stefanick ML, et al.: JAMA 2006; 295(14): 1647-57.
8
Beral V, et al.: Lancet 2003; 362: 419-27.
9
Manson JE, et al.: N Engl J Med 2003; 349(6): 523-34.
10
Wassertheil-Smoller S, et al.: JAMA 2003; 289(20): 2673-84.
11
Hendrix SL, et al.: Circulation 2006; 113(20): 2425-34.
12
Shumaker SA, et al.: JAMA 2003; 289(20): 2651-62.
13
Shumaker SA, et al.: JAMA 2004; 291(24): 2947-58.
14
Rodriguez C, et al.: JAMA 2001; 285(11): 1460-5.
15
Lacey JV Jr, et al.: JAMA 2002; 288(3): 334-41.
16
Beral V, et al.: Lancet 2007; 369(9574): 1703-10.
17
Anderson GL, et al.: JAMA 2003; 290(13): 1739-48.
18
Cirillo DJ, et al.: JAMA 2005; 293(3): 330-9.
19
久光製薬社内資料. 第I相臨床試験(単回投与試験)(2008年10月16日承認、CTD2.7.2.2).
20
久光製薬社内資料. 第I相臨床試験(反復投与試験)(2008年10月16日承認、CTD2.7.2.2).
21
久光製薬社内資料. 第II相臨床試験(プラセボ対照二重盲検比較試験)(2008年10月16日承認、CTD2.7.2.1、2.7.4.2).
22
久光製薬社内資料. 薬物動態試験(血漿蛋白結合率、組織への移行性、排泄試験)(2008年10月16日承認、CTD2.6.4.4、2.6.4.6、2.7.2.2).
23
本庄英雄: 日本臨床 1979; 37(6): 1186-92.
24
Singh H, et al.: Am J Obstet Gynecol 1979; 135(3): 409-14.
25
Stanczyk FZ, et al.: Contraception 1990; 42(1): 67-96.
26
Braselton WE, et al.: J Steroid Biochem 1977; 8(1): 9-18.
27
真田光博 ほか: 日本更年期医学会雑誌 2008; 16(2): 220-31.
28
久光製薬社内資料. 薬効薬理試験(子宮内膜に対する作用)(2008年10月16日承認、CTD2.6.2.2).