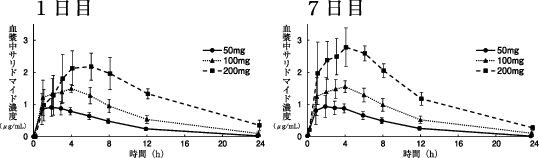
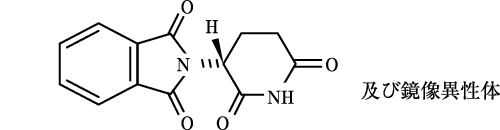
1
藤本製薬株式会社:サリドマイド製剤安全管理手順
2
石井 則久 他:Jpn J Lepr. 2011;80:275-285
3
Teo SK, et al.:J Chromatogr B Analyt Technol Biomed Life Sci. 2002;767:145-151
4
Teo SK, et al.:Toxicol Sci. 2004;81:379-389
5
社内資料:サレドカプセル50・100の薬物動態試験(反復投与)のまとめ
6
社内資料:サレドカプセル100の薬物動態試験(食事の影響)のまとめ
7
Koransky W, et al.:Proc Soc Exp Biol Med. 1964;116:512-516
8
Nicholls PJ.:J Pharm Pharmacol. 1966;18:46-48
9
Fabro S, et al.:Biochem J. 1967;104:565-569
10
Schumacher HJ, et al.:J Pharmacol Exp Ther. 1970;173:265-269
11
Eriksson T, et al.:Chirality. 1998;10:223-228
12
Schumacher H, et al.:Br J Pharmacol Chemother. 1965;25:324-337
13
Lu J, et al.:Clin Cancer Res. 2003;9:1680-1688
14
Eriksson T, et al.:J Pharm Pharmacol. 1998;50:1409-1416
15
Teo SK, et al.:J Biochem Mol Toxicol. 2000;14:140-147
16
Ando Y, et al.:Cancer Biol Ther. 2002;1:669-673
17
Chung F, et al.:Clin Cancer Res. 2004;10:5949-5956
18
Schumacher H, et al.:J Pharmacol Exp Ther. 1968;160:201-211
19
社内資料:FPF300の多発性骨髄腫に対する臨床試験まとめ
20
D'Amato RJ, et al.:Proc Natl Acad Sci USA. 1994;91:4082-4085
21
Sampaio EP, et al.:J Exp Med. 1991;173:699-703
22
Gupta D, et al.:Leukemia. 2001;15:1950-1961
23
Davies FE, et al.:Blood. 2001;98:210-216
24
Haslett PAJ, et al.:J Exp Med. 1998;187:1885-1892
25
Hideshima T, et al.:Blood. 2000;96:2943-2950
26
Moller DR, et al.:J Immunol. 1997;159:5157-5161
27
Lee DJ, et al.:J Infect Dis. 2010;201:558-569
28
Shannon EJ, et al.:Int Immunopharmacol. 2010;10:487-492
29
社内資料:FPF300のクロウ・深瀬(POEMS)症候群に対する臨床試験(2021年2月24日承認、CTD2.7.6.1)
30
造血器腫瘍診療ガイドライン 2018年版補訂版:日本血液学会編
31
Katsuse K, et al.:Clin Neurol Neurosurg. 2020;192:105709