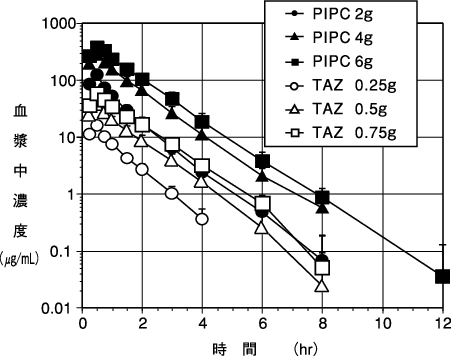
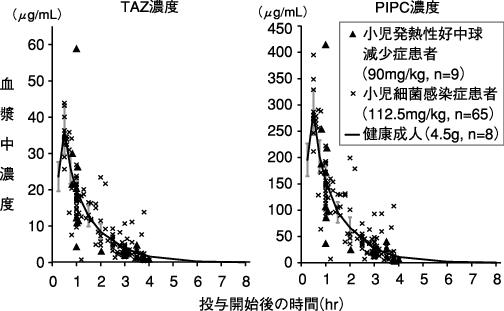
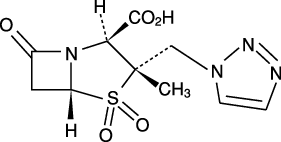
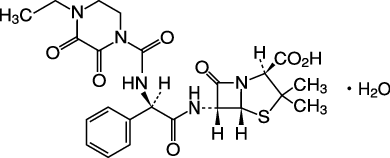
1
厚生労働省 : 重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
2
社内資料 :
3
柴 孝也 : 日本化学療法学会雑誌. 2010 ; 58(S-1): 1-10
4
砂川慶介 他 : 日本化学療法学会雑誌. 2010 ; 58(S-1): 88-102
5
Tamura, K. et al. : J. Infect. Chemother. 2015 ; 21 : 654-662
6
藤井良知 他 : Jpn. J. Antibiot. 1995 ; 48(3): 311-345
7
大石和徳 他 : Chemotherapy. 1994 ; 42(S-2): 452-467
8
渡辺 彰 他 : Chemotherapy. 1994 ; 42(S-2): 332-345
9
宮本直哉 他 : Chemotherapy. 1994 ; 42(S-2): 636-641
10
北川敏博 他 : Chemotherapy. 1994 ; 42(S-2): 559-567
11
谷村 弘 他 : Chemotherapy. 1994 ; 42(S-2): 612-628
12
清水宏之 他 : Chemotherapy. 1994 ; 42(S-2): 568-571
13
保田仁介 他 : Chemotherapy. 1994 ; 42(S-2): 657-665
14
神崎寛子 他 : Chemotherapy. 1994 ; 42(S-2): 666-670
15
宍戸春美 他 : Tazobactam/Piperacillinの肺組織及び胸水中移行(承認年月日:2008年7月16日、CTD2.5.3.1)
16
松本慶蔵 他 : Chemotherapy. 1994 ; 42(S-2): 281-299
17
hOAT1発現S2細胞,hOAT3発現S2細胞及びhOAT4発現S2細胞への放射性標識リガンドの取り込みに及ぼすタゾバクタム及びピペラシリンの影響(承認年月日:2008年7月16日、CTD2.5.3.1、2.7.2.2)
18
腎機能障害患者での薬物動態(承認年月日:2008年7月16日、CTD2.7.6.6)
19
柴 孝也 他 : 日本化学療法学会雑誌. 2010 ; 58(S-1): 73-87
20
荒川創一 他 : 日本化学療法学会雑誌. 2010 ; 58(S-1): 62-72
21
渡辺 彰 他 : 日本化学療法学会雑誌. 2010 ; 58(S-1): 11-28
22
渡辺 彰 他 : 日本化学療法学会雑誌. 2010 ; 58(S-1): 29-49
23
相川直樹 他 : 日本化学療法学会雑誌. 2010 ; 58(S-1): 50-61
24
三鴨廣繁 他 : 日本化学療法学会雑誌. 2012 ; 60(5): 560-572
25
西野武志 他 : Chemotherapy. 1994 ; 42(S-2): 73-101
26
欅田千恵子 他 : Chemotherapy. 1994 ; 42(S-2): 135-155
27
Higashitani, F. et al. : J. Antimicrob. Chemother. 1990 ; 25(4): 567-574
28
桒原(新井)京子 他 : Chemotherapy. 1994 ; 42(S-2): 51-61
29
南 新三郎 他 : Chemotherapy. 1994 ; 42(S-2): 164-177
30
石井良和 他 : Therapeutic Research. 1994 ; 15 : 4135-4139
31
伊東優子 他 : 各種細菌に対するYP-18の抗菌活性(承認年月日:2008年7月16日、CTD2.4.2.1、2.6.2.2)
32
伊東優子 他 : β-ラクタマーゼ産生菌に対するYP-18の抗菌活性(承認年月日:2008年7月16日、CTD2.4.2.2、2.6.2.2)
33
田中知暁 他 : β-Lactamase-producing amoxicillin/clavulanic acid-resistant Haemophilus influenzae(BLPACR)に対するYP-18の抗菌活性(承認年月日:2008年7月16日、CTD2.4.2.3、2.6.2.2)
34
福田淑子 他 : In vitro pharmacokinetic modelにおける基質特異性拡張型β-ラクタマーゼ(ESBL)産生菌に対するYP-18の殺菌効果(承認年月日:2008年7月16日、CTD2.4.2.4、2.6.2.2)
35
山口惠三 他 : 日本化学療法学会雑誌. 2011 ; 59(2): 177-187
36
Kuck, NA. et al. : Antimicrob. Agents Chemother. 1989 ; 33(11): 1964-1969