作成又は改訂年月
**
2019年12月改訂
(第10版)
*
2016年11月改訂
日本標準商品分類番号
薬効分類名
セロトニン・ノルアドレナリン再取り込み阻害剤(SNRI)
承認等
販売名
ミルナシプラン塩酸塩錠12.5mg「日医工」
販売名コード
承認・許可番号
22200AMX00121000
Milnacipran Hydrochloride
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存,湿気を避けて保存
使用期限
外箱等に表示の使用期限内に使用すること
規制区分
劇薬
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
1錠中
ミルナシプラン塩酸塩
12.5mg
添加物
D-マンニトール,無水ケイ酸,ヒプロメロース,ステアリン酸マグネシウム,ヒドロキシプロピルセルロース,酸化チタン,カルナウバロウ
性状
| 剤形 | フィルムコーティング錠 |
|---|
| 色調 | 白色〜帯黄白色 |
|---|
| 外形:表面 |  |
|---|
| 外形:裏面 |  |
|---|
| 外形:側面 |  |
|---|
| 直径 | 6.2mm |
|---|
| 厚さ | 2.7mm |
|---|
| 質量 | 80mg |
|---|
| 本体コード |  038 038 |
|---|
| 包装コード |  038 038 |
|---|
販売名
ミルナシプラン塩酸塩錠15mg「日医工」
販売名コード
承認・許可番号
22000AMX00987000
Milnacipran Hydrochloride
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存,湿気を避けて保存
使用期限
外箱等に表示の使用期限内に使用すること
規制区分
劇薬
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
1錠中
ミルナシプラン塩酸塩
15mg
添加物
D-マンニトール,ヒプロメロース,無水ケイ酸,ステアリン酸マグネシウム,ヒドロキシプロピルセルロース,酸化チタン,黄色三二酸化鉄,カルナウバロウ
性状
| 剤形 | フィルムコーティング錠 |
|---|
| 色調 | 淡黄色 |
|---|
| 外形:表面 |  |
|---|
| 外形:裏面 |  |
|---|
| 外形:側面 |  |
|---|
| 直径 | 6.2mm |
|---|
| 厚さ | 2.7mm |
|---|
| 質量 | 80mg |
|---|
| 本体コード |  032 032 |
|---|
| 包装コード |  032 032 |
|---|
販売名
ミルナシプラン塩酸塩錠25mg「日医工」
販売名コード
承認・許可番号
22000AMX00986000
Milnacipran Hydrochloride
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存,湿気を避けて保存
使用期限
外箱等に表示の使用期限内に使用すること
規制区分
劇薬
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
1錠中
ミルナシプラン塩酸塩
25mg
添加物
D-マンニトール,ヒプロメロース,無水ケイ酸,ステアリン酸マグネシウム,ヒドロキシプロピルセルロース,酸化チタン,カルナウバロウ
性状
| 剤形 | 割線入りのフィルムコーティング錠 |
|---|
| 色調 | 白色〜帯黄白色 |
|---|
| 外形:表面 |  |
|---|
| 外形:裏面 |  |
|---|
| 外形:側面 |  |
|---|
| 直径 | 6.2mm |
|---|
| 厚さ | 2.8mm |
|---|
| 質量 | 80mg |
|---|
| 本体コード |  034 034 |
|---|
| 包装コード |  034 034 |
|---|
販売名
ミルナシプラン塩酸塩錠50mg「日医工」
販売名コード
承認・許可番号
22200AMX00122000
Milnacipran Hydrochloride
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存,湿気を避けて保存
使用期限
外箱等に表示の使用期限内に使用すること
規制区分
劇薬
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
1錠中
ミルナシプラン塩酸塩
50mg
添加物
D-マンニトール,無水ケイ酸,ヒプロメロース,ステアリン酸マグネシウム,ヒドロキシプロピルセルロース,酸化チタン,カルナウバロウ
性状
| 剤形 | フィルムコーティング錠 |
|---|
| 色調 | 白色〜帯黄白色 |
|---|
| 外形:表面 |  |
|---|
| 外形:裏面 |  |
|---|
| 外形:側面 |  |
|---|
| 直径 | 7.7mm |
|---|
| 厚さ | 3.4mm |
|---|
| 質量 | 158mg |
|---|
| 本体コード |  039 039
50 |
|---|
| 包装コード |  039 039 |
|---|
一般的名称
禁忌
本剤の成分に対し過敏症の既往歴のある患者
**モノアミン酸化酵素阻害剤を投与中あるいは投与中止後2週間以内の患者(「相互作用」の項参照)
尿閉(前立腺疾患等)のある患者[本剤はノルアドレナリン再取り込み阻害作用を有するため,症状を悪化させるおそれがある。]
効能又は効果
効能又は効果に関連する使用上の注意
抗うつ剤の投与により,24歳以下の患者で,自殺念慮,自殺企図のリスクが増加するとの報告があるため,本剤の投与にあたっては,リスクとベネフィットを考慮すること。
本剤の有効性は,四環系抗うつ薬(ミアンセリン塩酸塩)と同等と判断されているものの,三環系抗うつ薬(イミプラミン塩酸塩)との非劣性は検証されていないため,投与に際しては,リスクとベネフィットを勘案すること。
類薬において,海外で実施された18歳以下の大うつ病性障害患者を対象としたプラセボ対照臨床試験において有効性が確認できなかったとの報告がある。本剤を18歳未満の大うつ病性障害患者に投与する際には適応を慎重に検討すること。(「小児等への投与」の項参照)
用法及び用量
通常,成人には,ミルナシプラン塩酸塩として1日25mgを初期用量とし,1日100mgまで漸増し,1日2〜3回に分けて食後に経口投与する。なお,年齢,症状により適宜増減する。
ただし,高齢者には,1日25mgを初期用量とし,1日60mgまで漸増し,1日2〜3回に分けて食後に経口投与する。
使用上の注意
慎重投与
排尿困難のある患者[本剤はノルアドレナリン再取り込み阻害作用を有するため,症状を悪化させるおそれがある。]
緑内障又は眼内圧亢進のある患者[症状を悪化させるおそれがある。]
心疾患のある患者[血圧上昇,頻脈等があらわれ,症状を悪化させるおそれがある。]
高血圧のある患者[高血圧クリーゼがあらわれることがある。]
肝障害のある患者[高い血中濃度が持続するおそれがある。]
腎障害のある患者[外国における腎機能障害患者での体内薬物動態試験で,高い血中濃度が持続する傾向が認められているので,投与量を減じて使用すること。]
てんかん等の痙攣性疾患又はこれらの既往歴のある患者[痙攣を起こすことがある。]
躁うつ病患者[躁転,自殺企図があらわれることがある。]
自殺念慮又は自殺企図の既往のある患者,自殺念慮のある患者[自殺念慮,自殺企図があらわれることがある。]
脳の器質障害又は統合失調症の素因のある患者[精神症状を増悪させることがある。]
衝動性が高い併存障害を有する患者[精神症状を増悪させることがある。]
小児(「小児等への投与」の項参照)
高齢者(「高齢者への投与」の項参照)
重要な基本的注意
うつ症状を呈する患者は希死念慮があり,自殺企図のおそれがあるので,このような患者は投与開始早期ならびに投与量を変更する際には患者の状態及び病態の変化を注意深く観察すること。
不安,焦燥,興奮,パニック発作,不眠,易刺激性,敵意,攻撃性,衝動性,アカシジア/精神運動不穏,軽躁,躁病等があらわれることが報告されている。また,因果関係は明らかではないが,これらの症状・行動を来した症例において,基礎疾患の悪化又は自殺念慮,自殺企図,他害行為が報告されている。患者の状態及び病態の変化を注意深く観察するとともに,これらの症状の増悪が観察された場合には,服薬量を増量せず,徐々に減量し,中止するなど適切な処置を行うこと。
自殺目的での過量服用を防ぐため,自殺傾向が認められる患者に処方する場合には,1回分の処方日数を最小限にとどめること。
家族等に自殺念慮や自殺企図,興奮,攻撃性,易刺激性等の行動の変化及び基礎疾患悪化があらわれるリスク等について十分説明を行い,医師と緊密に連絡を取り合うよう指導すること。
*眠気,めまい等が起こることがあるので,自動車の運転等危険を伴う機械を操作する際には十分注意させること。また,患者に,これらの症状を自覚した場合は自動車の運転等危険を伴う機械の操作に従事しないよう,指導すること。
高血圧クリーゼ,血圧上昇があらわれることがあるので,適宜血圧・脈拍数等を測定し,異常が認められた場合には,減量,休薬又は中止するなど適切な処置を行うこと。特に,高血圧又は心疾患のある患者に対しては定期的に測定すること。
相互作用
併用禁忌
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
モノアミン酸化酵素阻害剤
セレギリン塩酸塩(エフピー)
**ラサギリンメシル酸塩(アジレクト)
**サフィナミドメシル酸塩(エクフィナ) | 他の抗うつ剤で併用により発汗,不穏,全身痙攣,異常高熱,昏睡等の症状があらわれることが報告されている。
モノアミン酸化酵素阻害剤の投与を受けた患者に本剤を投与する場合には,少なくとも2週間の間隔をおき,また,本剤からモノアミン酸化酵素阻害剤に切り替えるときは2〜3日間の間隔をおくことが望ましい。 | 主にモノアミン酸化酵素阻害剤による神経外アミン総量の増加及び抗うつ剤によるモノアミン作動性神経終末におけるアミン再取り込み阻害によると考えられている。 |
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| アルコール | 他の抗うつ剤で相互に作用を増強することが報告されている。 | アルコールは中枢神経抑制作用を有する。 |
中枢神経抑制剤
バルビツール酸誘導体等 | 相互に作用を増強するおそれがある。 | 機序は不明。 |
降圧剤
クロニジン等 | 降圧剤の作用を減弱する可能性があるので,観察を十分に行うこと。 | 本剤のノルアドレナリン再取り込み阻害作用によると考えられる。 |
| 炭酸リチウム | 他の抗うつ剤で併用によりセロトニン症候群があらわれることが報告されている。 | 機序は不明。 |
5-HT1B/1D受容体作動薬
スマトリプタンコハク酸塩等 | 他の抗うつ剤で併用により高血圧,冠動脈収縮があらわれることが報告されている。 | 本剤はセロトニン再取り込み阻害作用を有するため,併用によりセロトニン作用が増強するおそれがある。 |
| **リスデキサンフェタミンメシル酸塩 | セロトニン症候群があらわれるおそれがある。 | 本剤はセロトニン再取り込み阻害作用を有するため,併用によりセロトニン作用が増強するおそれがある。 |
| メチルチオニニウム塩化物水和物(メチレンブルー) | セロトニン症候群があらわれるおそれがある。 | 左記薬剤のMAO阻害作用によりセロトニン作用が増強される。 |
| ジゴキシン | ジゴキシンの静脈内投与との併用により起立性低血圧,頻脈があらわれたとの報告がある。 | 機序は不明。 |
アドレナリン
ノルアドレナリン | これらの薬剤(特に注射剤)との併用により,心血管作用(血圧上昇等)を増強するおそれがある。 | 本剤はノルアドレナリン再取り込み阻害作用を有するため,併用によりアドレナリン作用が増強するおそれがある。 |
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
悪性症候群(Syndrome malin)(頻度不明)
無動緘黙,強度の筋強剛,嚥下困難,頻脈,血圧の変動,発汗等が発現し,それに引き続き発熱がみられる悪性症候群があらわれることがあるので,このような症状があらわれた場合には,投与を中止し,体冷却,水分補給等の全身管理とともに適切な処置を行うこと。
セロトニン症候群(頻度不明)
セロトニン症候群があらわれることがあるので,激越,錯乱,発汗,幻覚,反射亢進,ミオクロヌス,戦慄,頻脈,振戦,発熱,協調異常等が認められた場合には,投与を中止し,水分補給等の全身管理とともに適切な処置を行うこと。
痙攣(頻度不明)
痙攣があらわれることがあるので,異常が認められた場合には,投与を中止し,適切な処置を行うこと。
白血球減少(頻度不明)
白血球減少があらわれることがあるので,血液検査等の観察を十分に行い,異常が認められた場合には,投与を中止し,適切な処置を行うこと。
重篤な皮膚障害(頻度不明)
皮膚粘膜眼症候群(Stevens-Johnson症候群)等の重篤な皮膚障害があらわれることがあるので,観察を十分に行い,発熱,紅斑,そう痒感,眼充血,口内炎等があらわれた場合には,投与を中止し,適切な処置を行うこと。
抗利尿ホルモン不適合分泌症候群(SIADH)(頻度不明)
低ナトリウム血症,低浸透圧血症,尿中ナトリウム増加,高張尿,意識障害等を伴う抗利尿ホルモン不適合分泌症候群があらわれることがあるので,食欲不振,頭痛,嘔気,嘔吐,全身倦怠感等があらわれた場合には電解質の測定を行い,異常が認められた場合には,投与を中止し,水分摂取制限等の適切な処置を行うこと。
肝機能障害,黄疸(頻度不明)
AST(GOT),ALT(GPT),γ-GTPの上昇等を伴う肝機能障害,黄疸があらわれることがあるので,観察を十分に行い,異常が認められた場合には,投与を中止し,適切な処置を行うこと。
高血圧クリーゼ(頻度不明)
高血圧クリーゼがあらわれることがあるので,血圧の推移等に十分注意しながら投与すること。異常が認められた場合には投与を中止し,適切な処置を行うこと。
その他の副作用
| | 頻度不明 |
| 循環器 | 起立性低血圧,頻脈,動悸,血圧上昇,血圧低下,上室性頻拍 |
| 精神神経系注1) | 眠気,めまい,ふらつき,立ちくらみ,頭痛,振戦,視調節障害,躁転,焦躁感,知覚減退(しびれ感等),不眠,頭がボーッとする,筋緊張亢進,アカシジア・口部ジスキネジア・パーキンソン様症状等の錐体外路障害,不安,幻覚,せん妄,被注察感,聴覚過敏,自生思考 |
| 過敏症注2) | 発疹,そう痒感 |
| 消化器 | 悪心・嘔吐,便秘,口渇,腹痛,腹部膨満感,胸やけ,味覚異常,舌異常,食欲不振,食欲亢進,口内炎,下痢,飲水量増加 |
| 肝臓注3) | AST(GOT)上昇,ALT(GPT)上昇,γ-GTP上昇 |
| 泌尿器 | 排尿障害,頻尿,尿蛋白陽性,尿失禁 |
| その他 | 倦怠感,発汗,熱感,発熱,悪寒,冷感,耳鳴,息苦しい,性機能異常(勃起力減退,射精障害,精巣痛,精液漏等),トリグリセライドの上昇,鼻閉,関節痛,浮腫,CK(CPK)上昇,脱力感,胸痛,脱毛 |
高齢者への投与
高齢者での体内薬物動態試験で,血中濃度が上昇し,薬物の消失が遅延する傾向が認められているので,患者の状態を観察しながら慎重に投与すること。また,低ナトリウム血症,抗利尿ホルモン不適合分泌症候群は主に高齢者において報告されているので,注意すること。
妊婦,産婦,授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には,治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[ラットに経口投与した実験で,胎児への移行(胎児中濃度は母体血液中濃度と同程度)が報告されている。]
動物における周産期及び授乳期投与試験で,死産児の増加等が報告されている。
授乳中の婦人には投与しないことが望ましいが,やむを得ず投与する場合には授乳を避けさせること。[ラットに経口投与した実験で,乳汁への移行(乳汁中濃度は血漿中濃度の3倍)が報告されている。]
小児等への投与
小児等に対する安全性は確立していない(使用経験がない)。
本剤の小児に対する有効性及び安全性を検証するための試験は行われていない。
類薬において,海外で実施された18歳以下の大うつ病性障害(DSM-IV※における分類)患者を対象としたプラセボ対照の臨床試験において有効性が確認できなかったとの報告がある。
※DSM-IV:American Psychiatric Association(米国精神医学会)のDiagnostic and Statistical Manual of Mental Disorders,4th edition(DSM-IV精神疾患の診断・統計マニュアル)
過量投与
徴候,症状
外国において,本剤800mg〜1gで,嘔吐,呼吸困難(無呼吸期),頻脈がみられている。1.9〜2.8gを他の薬剤(特にベンゾジアゼピン系薬剤)と併用した場合,傾眠,高炭酸血症,意識障害がみられている。
処置
特異的な解毒剤は知られていない。できるだけ速やかに胃洗浄,活性炭投与等の適切な処置を行うこと。
適用上の注意
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により,硬い鋭角部が食道粘膜へ刺入し,更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
服用時
空腹時に服用すると嘔気,嘔吐が強く出現するおそれがあるので,空腹時の服用は避けさせること。
その他の注意
海外で実施された大うつ病性障害等の精神疾患を有する患者を対象とした,複数の抗うつ剤の短期プラセボ対照臨床試験の検討結果において,24歳以下の患者では,自殺念慮や自殺企図の発現のリスクが抗うつ剤投与群でプラセボ群と比較して高かった。なお,25歳以上の患者における自殺念慮や自殺企図の発現のリスクの上昇は認められず,65歳以上においてはそのリスクが減少した。
主に50歳以上を対象に実施された海外の疫学調査において,選択的セロトニン再取り込み阻害剤及び三環系抗うつ剤を含む抗うつ剤を投与された患者で,骨折のリスクが上昇したとの報告がある。
薬物動態
生物学的同等性試験
ミルナシプラン塩酸塩錠15mg「日医工」及び標準製剤を,クロスオーバー法によりそれぞれ1錠(ミルナシプラン塩酸塩として15mg)健康成人男子に絶食単回経口投与して血漿中ミルナシプラン濃度を測定し,得られた薬物動態パラメータ(AUC,Cmax)について90%信頼区間法にて統計解析を行った結果,log(0.8)〜log(1.25)の範囲内であり,両剤の生物学的同等性が確認された。
1)
また,ミルナシプラン塩酸塩錠25mg「日医工」及び標準製剤をそれぞれ1錠(ミルナシプラン塩酸塩として25mg)投与した場合においても,同様に両剤の生物学的同等性が確認された。1)(注意:本剤の承認用法は食後投与である。)
ミルナシプラン塩酸塩錠12.5mg「日医工」は,「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成18年11月24日 薬食審査発第1124004号)」に基づき,ミルナシプラン塩酸塩錠15mg「日医工」を標準製剤としたとき,溶出挙動が等しく,生物学的に同等とみなされた。
2)同様に,ミルナシプラン塩酸塩錠50mg「日医工」は,ミルナシプラン塩酸塩錠25mg「日医工」を標準製剤としたとき,溶出挙動が等しく,生物学的に同等とみなされた。
2)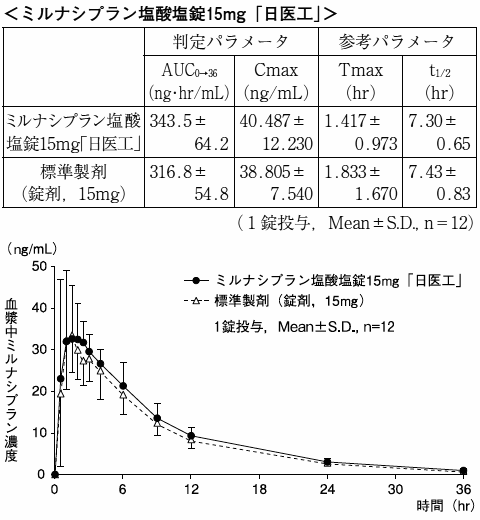
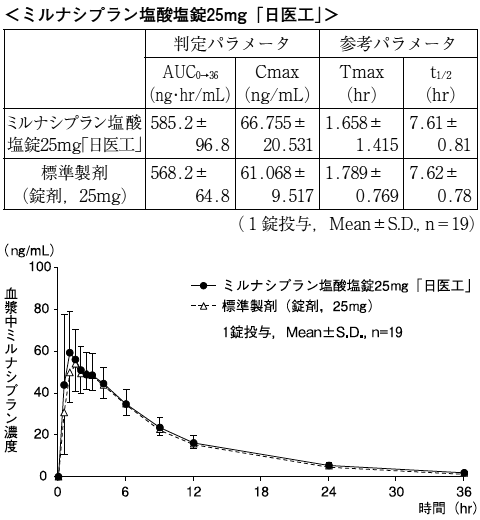
血漿中濃度並びにAUC,Cmax等のパラメータは,被験者の選択,体液の採取回数・時間等の試験条件によって異なる可能性がある。
溶出挙動
ミルナシプラン塩酸塩錠15mg「日医工」及びミルナシプラン塩酸塩錠25mg「日医工」は,日本薬局方外医薬品規格第3部に定められたミルナシプラン塩酸塩錠の溶出規格に適合していることが確認されている。3)
薬効薬理
セロトニン及びノルアドレナリン再取り込み阻害薬である。
再取り込みを阻害することで神経伝達を促進できるのは,シナプスからの伝達物質のクリアランスを遅らせ,シナプスにおける伝達物質の残存期間を長くすることによると推定される。4)
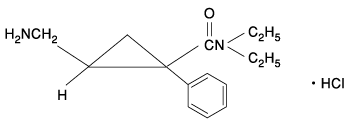
有効成分に関する理化学的知見
一般名
ミルナシプラン塩酸塩(Milnacipran Hydrochloride)
化学名
(±)-cis-2-Aminomethyl-N,N-diethyl-1-phenylcyclopropane-carboxamide monohydrochloride
構造式
分子式
C15H22N2O・HCl
分子量
282.81
性状
白色の結晶性の粉末である。
水,エタノール(99.5)及びN,N-ジメチルホルムアミドに溶けやすく,アセトニトリルにやや溶けにくい。
水溶液(1→100)は旋光性を示さない。
融点
約170℃(分解)
取扱い上の注意
安定性試験
本品につき加速試験(40℃,相対湿度75%,6ヵ月)を行った結果,ミルナシプラン塩酸塩錠12.5mg「日医工」,ミルナシプラン塩酸塩錠15mg「日医工」,ミルナシプラン塩酸塩錠25mg「日医工」及びミルナシプラン塩酸塩錠50mg「日医工」は通常の市場流通下において3年間安定であることが推測された。5)
包装
ミルナシプラン塩酸塩錠12.5mg「日医工」
100錠(10錠×10;PTP)
ミルナシプラン塩酸塩錠15mg「日医工」
100錠(10錠×10;PTP)
ミルナシプラン塩酸塩錠25mg「日医工」
100錠(10錠×10;PTP)
500錠(バラ)
ミルナシプラン塩酸塩錠50mg「日医工」
100錠(10錠×10;PTP)
主要文献及び文献請求先
主要文献
1
前田 彰 他:新薬と臨牀,57(6),952(2008)
2
日医工株式会社 社内資料:生物学的同等性試験
3
日医工株式会社 社内資料:溶出試験
4
グッドマン・ギルマン薬理書(上)薬物治療の基礎と臨床 第12版 496,廣川書店,2013
5
日医工株式会社 社内資料:安定性試験
文献請求先
主要文献欄に記載の文献・社内資料は下記にご請求下さい。
日医工株式会社 お客様サポートセンター
〒930-8583 富山市総曲輪1丁目6番21
フリーダイアル(0120)517-215
Fax(076)442-8948
製造販売業者等の氏名又は名称及び住所
製造販売元
日医工株式会社
富山市総曲輪1丁目6番21



 038
038 038
038


 032
032 032
032


 034
034 034
034


 039
039 039
039