作成又は改訂年月
**
2023年10月改訂
(第18版)
*
2021年2月改訂
日本標準商品分類番号
日本標準商品分類番号等
1994年3月
1989年9月
薬効分類名
承認等
販売名
ミルタックスパップ30mg
販売名コード
承認・許可番号
22000AMX00132
MILTAX PAP
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存(「取扱い上の注意」の項参照)
使用期限
包装に表示の使用期限内に使用すること。
組成
1枚中に次の成分を含有
有効成分
ケトプロフェン(日局) 30mg
添加物
N-メチル-2-ピロリドン、l -メントール、ポリアクリル酸部分中和物、ポリアクリル酸ナトリウム、カルメロースナトリウム、ゼラチン、乾燥水酸化アルミニウムゲル、硫酸アルミニウム、トリオレイン酸ポリオキシエチレンソルビタン(20E.O.)、濃グリセリン、エデト酸ナトリウム水和物、チモール、オキシベンゾン、軽質無水ケイ酸、pH調節剤
性状
| 剤形 | パップ剤
1枚:10cm×14cm、膏体10g
膏体の表面は透明なフィルムで覆われている。 |
|---|
| 色 | 淡黄白色〜黄白色 |
|---|
一般的名称
禁忌
本剤又は本剤の成分に対して過敏症の既往歴のある患者(「重要な基本的注意」の項参照)
アスピリン喘息(非ステロイド性消炎鎮痛薬等による喘息発作の誘発)又はその既往歴のある患者[喘息発作を誘発するおそれがある。](「重大な副作用」の項参照)
チアプロフェン酸、スプロフェン、フェノフィブラートならびにオキシベンゾン及びオクトクリレンを含有する製品(サンスクリーン、香水等)に対して過敏症の既往歴のある患者[これらの成分に対して過敏症の既往歴のある患者では、本剤に対しても過敏症を示すおそれがある。]
光線過敏症の既往歴のある患者[光線過敏症を誘発するおそれがある。]
妊娠後期の女性(「妊婦、産婦、授乳婦等への使用」の項参照)
効能又は効果
効能又は効果に関連する使用上の注意
本剤の使用により重篤な接触皮膚炎、光線過敏症が発現することがあり、中には重度の全身性発疹に進展する例が報告されているので、疾病の治療上の必要性を十分に検討の上、治療上の有益性が危険性を上回る場合にのみ使用すること。
損傷皮膚には本剤を使用しないこと。
下記疾患ならびに症状の鎮痛・消炎
変形性関節症、肩関節周囲炎、腱・腱鞘炎、腱周囲炎、上腕骨上顆炎(テニス肘等)、筋肉痛、外傷後の腫脹・疼痛
用法及び用量
使用上の注意
慎重投与
気管支喘息のある患者[アスピリン喘息患者が潜在しているおそれがある。](「重大な副作用」の項参照)
重要な基本的注意
本剤又は本剤の成分により過敏症(紅斑、発疹・発赤、腫脹、刺激感、そう痒等を含む)を発現したことのある患者には使用しないこと。
接触皮膚炎又は光線過敏症を発現することがあり、中には重度の全身性発疹に至った症例も報告されているので、使用前に患者に対し次の指導を十分に行うこと(「重大な副作用」の項参照)。
紫外線曝露の有無にかかわらず、接触皮膚炎を発現することがあるので、発疹・発赤、そう痒感、刺激感等の皮膚症状が認められた場合には、直ちに使用を中止し、患部を遮光し、受診すること。なお、使用後数日を経過して発現する場合があるので、同様に注意すること。
光線過敏症を発現することがあるので、使用中は天候にかかわらず、戸外の活動を避けるとともに、日常の外出時も、本剤貼付部を衣服、サポーター等で遮光すること。なお、白い生地や薄手の服は紫外線を透過させるおそれがあるので、紫外線を透過させにくい色物の衣服などを着用すること。また、使用後数日から数ヵ月を経過して発現することもあるので、使用後も当分の間、同様に注意すること。異常が認められた場合には直ちに本剤の使用を中止し、患部を遮光し、適切な処置を行うこと。
消炎鎮痛薬による治療は原因療法ではなく、対症療法であることに留意すること。
皮膚の感染症を不顕性化するおそれがあるので、感染を伴う炎症に対して用いる場合には適切な抗菌薬又は抗真菌薬を併用し、観察を十分に行い慎重に使用すること。
慢性疾患(変形性関節症等)に対し本剤を用いる場合には薬物療法以外の療法も考慮すること。また患者の状態を十分に観察し、副作用の発現に留意すること。
副作用
承認前の調査1,503例中報告された副作用は3.3%(50例)で、主な副作用はかぶれ1.0%(15件)、そう痒感0.9%(14件)、発疹0.8%(12件)等の貼付部位の皮膚症状であった。
承認後における使用成績調査(4年間)1)5,447例中報告された副作用は1.1%(60例)であり、主な副作用は発赤0.5%(27件)、そう痒感0.3%(16件)、接触皮膚炎0.2%(12件)、発疹0.2%(9件)等の貼付部位の皮膚症状であった。
また、小児等(15歳以下)への使用例128例中副作用は報告されなかった。
重大な副作用
ショック、アナフィラキシー
頻度不明注1)
ショック、アナフィラキシー(蕁麻疹、呼吸困難、顔面浮腫等)があらわれることがあるので、観察を十分に行い、異常が認められた場合には使用を中止し、適切な処置を行うこと。
喘息発作の誘発(アスピリン喘息)
頻度不明注1)
喘息発作を誘発することがあるので、乾性ラ音、喘鳴、呼吸困難感等の初期症状が発現した場合は使用を中止すること。なお、本剤による喘息発作の誘発は、貼付後数時間で発現している。
接触皮膚炎
頻度不明注1)
本剤貼付部に発現したそう痒感、刺激感、紅斑、発疹・発赤等が悪化し、腫脹、浮腫、水疱・びらん等の重度の皮膚炎症状や色素沈着、色素脱失が発現し、さらに全身に皮膚炎症状が拡大し重篤化することがあるので、異常が認められた場合には直ちに使用を中止し、患部を遮光し、適切な処置を行うこと。なお、使用後数日を経過してから発現することもある。
光線過敏症
頻度不明注1)
本剤の貼付部を紫外線に曝露することにより、強いそう痒を伴う紅斑、発疹、刺激感、腫脹、浮腫、水疱・びらん等の重度の皮膚炎症状や色素沈着、色素脱失が発現し、さらに全身に皮膚炎症状が拡大し重篤化することがあるので、異常が認められた場合には直ちに使用を中止し、患部を遮光し、適切な処置を行うこと。なお、使用後数日から数ヵ月を経過してから発現することもある。
注1)自発報告において認められている副作用のため頻度不明。
その他の副作用
皮膚注2)
0.1〜5%未満
局所の発疹、発赤、腫脹、そう痒感、刺激感、水疱・びらん、色素沈着等
皮膚注2)
頻度不明
皮下出血
過敏症注2)
頻度不明
蕁麻疹、眼瞼浮腫、顔面浮腫
注2)このような症状があらわれた場合には直ちに使用を中止すること。
高齢者への投与
高齢者では、貼付部の皮膚の状態に注意しながら慎重に使用すること。
妊婦、産婦、授乳婦等への投与
ケトプロフェンの外皮用剤を妊娠後期の女性に使用した場合、胎児動脈管収縮が起きることがあるので、妊娠後期の女性には本剤を使用しないこと。
妊婦(妊娠後期以外)、産婦、授乳婦等に対する安全性は確立していないので、これらの患者に対しては、治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。
ケトプロフェンの外皮用剤を妊娠中期の女性に使用し、羊水過少症が起きたとの報告があるので、必要最小限の使用にとどめるなど慎重に使用すること。
*シクロオキシゲナーゼ阻害剤(経口剤、坐剤)を妊婦に使用し、胎児の腎機能障害及び尿量減少、それに伴う羊水過少症が起きたとの報告がある。
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない(使用経験が少ない)。
適用上の注意
使用部位:
使用部位の皮膚刺激を招くことがあるので、下記の部位には使用しないこと。
薬物動態
吸収
健康成人7例に本剤1枚を12時間単回貼付した場合、貼付開始12時間後までのケトプロフェンの平均経皮吸収量は4.00mgで、貼付量に対する平均吸収率は13.3%であった。
健康成人6例に本剤1枚を1日2回、28日間連続貼付した場合、ケトプロフェンの平均経皮吸収量は1日目に4.24mg/12hr、14日目以降4.01〜4.62mg/12hrで、また貼付量に対する平均吸収率は13.5〜18.6%/12hrであった。
血中濃度
健康成人7例に本剤1枚を12時間単回貼付した時、ケトプロフェンの平均血清中濃度は貼付開始12時間後に43.11ng/mLに達した後、24時間後には4.27ng/mLで、48時間後には0.15ng/mLと、血清中よりほとんど消失した。
健康成人6例に本剤1枚を1日2回、28日間連続貼付した時、ケトプロフェンの1日内最高平均血清中濃度は7日目に51.32ng/mLとなり、7日目以降はほぼ同等の値を示した。
分布2)
変形性膝関節症の治療、又は種々の整形外科的疾患で手術を必要とした患者の患部に本剤1枚を単回貼付した時、貼付開始8時間後のケトプロフェンの平均組織内濃度は、皮膚16,273ng/g、皮下脂肪4,298ng/g、筋肉581ng/g及び滑膜345ng/gで、血清中濃度2.78ng/mLに比べてはるかに高濃度であった。
排泄
健康成人7例に本剤1枚を12時間単回貼付した時、ケトプロフェンの平均累積尿中排泄量は貼付開始24時間後までに1.30mg、48時間後までに1.42mgで、総排泄量のほとんどが48時間後までに排泄された。
健康成人6例に本剤1枚を1日2回、28日間連続貼付した時、7日目の平均尿中排泄量は2.95mg/日で、7日目以降はほぼ一定となった。
臨床成績
国内で実施された二重盲検比較試験を含む臨床試験の概要は次のとおりである。
| 疾患名 | 改善率(%)[中等度改善以上/総症例] |
| 変形性関節症 | 58.3[342/587] |
| 肩関節周囲炎 | 55.7[54/97] |
| 腱・腱鞘炎、腱周囲炎 | 80.4[37/46] |
| 上腕骨上顆炎(テニス肘等) | 77.8[21/27] |
| 筋肉痛 | 72.2[135/187] |
| 外傷後の腫脹・疼痛 | 82.3[265/322] |
薬効薬理
ミルタックスパップ30mgは、至適濃度の薬物を目的とする部位に確実に輸送するドラッグデリバリーシステム(DDS)に基づいて経皮鎮痛消炎効果を発現する0.3%ケトプロフェンパップ剤である。
抗炎症作用3)
ラットのカラゲニン背部皮膚浮腫及び足浮腫、打撲足浮腫の急性炎症モデルにおいて有意な浮腫抑制作用を示した。またラットの綿球肉芽増殖及びアジュバント関節炎の慢性炎症モデル、モルモットの紫外線紅斑モデルにおいても有意な抗炎症作用を示した。
鎮痛作用3)
ラットのカオリン・カラゲニン炎症足疼痛及び硝酸銀関節炎の炎症性疼痛モデルにおいて有意な鎮痛作用を示した。
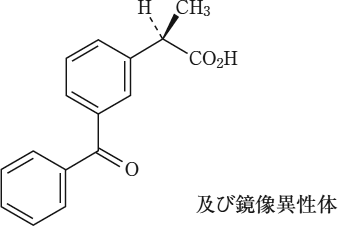
有効成分に関する理化学的知見
一般名
ケトプロフェン(Ketoprofen)
化学名
(2RS )-2-(3-Benzoylphenyl)propanoic acid
分子式
C16H14O3
分子量
254.28
構造式
性状
白色の結晶性の粉末である。メタノールに極めて溶けやすく、エタノール(95)又はアセトンに溶けやすく、水にほとんど溶けない。エタノール(99.5)溶液(1→100)は旋光性を示さない。光によって微黄色になる。
融点
94〜97℃
取扱い上の注意
保管方法
直射日光や高温を避けて保存すること。
開封後は、開封口のチャックを合わせて袋を密閉すること。
包装
ミルタックスパップ30mg 240枚[1袋(6枚)×40]
720枚[1袋(6枚)×120]
560枚[1袋(7枚)×80]
主要文献及び文献請求先
主要文献
1
青木虎吉ほか:新薬と臨床 1996; 45(4):891-905
2
菅原幸子ほか:薬理と治療 1986; 14(10):6631-6637
3
斉田 勝ほか:医薬品研究 1986; 17(6):1133-1143
文献請求先・製品情報お問い合わせ先
第一三共エスファ株式会社 お客様相談室
〒103-8426 東京都中央区日本橋本町3-5-1
TEL:0120-100-601
製造販売業者等の氏名又は名称及び住所
製造販売元
ニプロファーマ株式会社
**大阪府摂津市千里丘新町3番26号
販売元
第一三共エスファ株式会社
東京都中央区日本橋本町3-5-1
販売提携
第一三共株式会社
東京都中央区日本橋本町3-5-1