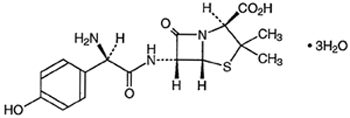
合成ペニシリン製剤
1g 8.9円
| 外観 | だいだい色・細粒 |
|---|---|
| におい | パイナップル臭 |
| 味 | 甘味 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| ワルファリンカリウム | ワルファリンカリウムの作用が増強されるおそれがある。 | 腸内細菌によるビタミンKの産生を抑制することがある。 |
| 経口避妊薬 | 経口避妊薬の効果が減弱するおそれがある。 | 腸内細菌叢を変化させ、経口避妊薬の腸肝循環による再吸収を抑制すると考えられる。 |
| プロベネシド | 本剤の血中濃度を増加させる。 | 本剤の尿細管分泌を阻害し、尿中排泄を低下させると考えられている。 |
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | そう痒、発熱 | |
| 血液 | 好酸球増多 | ||
| 消化器 | 食欲不振、下痢、悪心・嘔吐、腹痛、消化不良 | 黒毛舌 | |
| 菌交代症 | 口内炎、カンジダ症 | ||
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB欠乏症状(舌炎、口内炎、食欲不振、神経炎等) | ||
| その他 | 頭痛、めまい、耳鳴 | 梅毒患者の場合:ヤーリッシュ・ヘルクスハイマー反応(発熱、全身けん怠感、頭痛等の発現、病変部の悪化) |
| 5%以上注1) | 1〜5%未満注1) | 1%未満注1) | 頻度不明注2) | |
| 過敏症 | 発疹 | そう痒 | ||
| 精神神経系 | 頭痛、しびれ感、眠気、めまい、不眠、うつ状態 | |||
| 消化器 | 下痢(14.0%)、軟便(11.8%) | 味覚異常、腹部膨満感、腹痛、便秘 | 悪心、口内炎、口渇、舌炎、胸やけ、胃食道逆流、嘔吐、食欲不振 | 黒毛舌 |
| 血液※ | 好中球減少、好酸球増多、貧血 | 白血球増多 | ||
| 肝臓※ | AST(GOT)上昇、ALT(GPT)上昇、LDH上昇、γ-GTP上昇、Al-P上昇 | ビリルビン上昇 | ||
| その他 | トリグリセリド上昇、尿蛋白陽性、総コレステロール上昇・低下、尿糖陽性、膣モニリア症注3) | 尿酸上昇、けん怠感、熱感、浮腫、動悸、血圧上昇 |
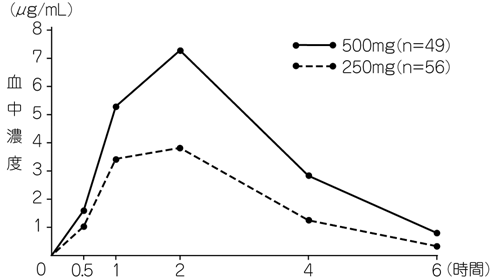
| Cmax (μg/mL) | Tmax (hr) | T1/2 (hr) | AUC (μg・hr/mL) |
| 10.05±1.62 | 1.67±0.52 | 1.0±0.2 | 29.04±7.15 |
| Cmax (μg/mL) | Tmax (hr) | T1/2 (hr) | AUC0〜12 (μg・hr/mL) |
| 9.86±2.79 | 1.63±0.37 | 1.09±0.19※ | 25.82±5.41※ |
| 疾患名 | 有効率 有効以上(%) | 有効率 やや有効以上(%) |
| 表在性皮膚感染症〔毛のう炎、膿か疹〕 | 23/35(65.7) | 34/35(97.1) |
| 深在性皮膚感染症〔せつ、よう、蜂か織炎、ひょう疽、耳せつ、鼻せつ〕 | 52/68(76.5) | 59/68(86.8) |
| リンパ管・リンパ節炎〔リンパ節炎〕 | 8/9(88.9) | 8/9(88.9) |
| 慢性膿皮症〔膿皮症、ざ瘡、膿瘍、感染粉瘤〕 | 19/29(65.5) | 25/29(86.2) |
| 外傷・熱傷及び手術創等の二次感染 〔創傷および手術後の二次感染〕 | 11/20(55.0) | 15/20(75.0) |
| びらん・潰瘍の二次感染〔じょく瘡〕 | 3/7(42.9) | 5/7(71.4) |
| 乳腺炎 | 7/10(70.0) | 8/10(80.0) |
| 骨髄炎 | 6/9(66.7) | 6/9(66.7) |
| 咽頭・喉頭炎〔咽頭炎〕 | 9/10(90.0) | 9/10(90.0) |
| 扁桃炎 | 80/95(84.2) | 82/95(86.3) |
| 急性気管支炎、慢性呼吸器病変の二次感染〔気管支炎〕 | 34/44(77.3) | 38/44(86.4) |
| 肺炎 | 58/68(85.3) | 61/68(89.7) |
| 膀胱炎 | 215/270(79.6) | 217/270(80.4) |
| 腎盂腎炎〔腎盂腎炎、腎盂炎〕 | 41/63(65.1) | 43/63(68.3) |
| 前立腺炎(急性症、慢性症) | 16/19(84.2) | 16/19(84.2) |
| 精巣上体炎(副睾丸炎) | 2/2(-) | 2/2(-) |
| 淋菌感染症〔淋疾〕 | 59/68(86.8) | 59/68(86.8) |
| 子宮内感染 | 27/35(77.1) | 27/35(77.1) |
| 子宮付属器炎 | 31/38(81.6) | 32/38(84.2) |
| 子宮旁結合織炎 | 2/4(-) | 2/4(-) |
| 涙のう炎 | 2/4(-) | 4/4(-) |
| 麦粒腫 | 20/32(62.5) | 26/32(81.3) |
| 中耳炎 | 44/54(81.5) | 45/54(83.3) |
| 歯周組織炎〔歯齦膿瘍、歯槽骨炎〕 | 11/14(78.6) | 11/14(78.6) |
| 歯冠周囲炎〔智歯周囲炎〕 | 9/14(64.3) | 12/14(85.7) |
| 顎炎〔急性顎炎、顎骨周囲炎〕 | 12/18(66.7) | 16/18(88.9) |
| 猩紅熱 | 42/43(97.7) | 43/43(100) |
| 各薬剤の1回投与量 | 投与回数 | 除菌率 胃潰瘍 | 除菌率 十二指腸潰瘍 |
| アモキシシリン水和物 750mg(力価) クラリスロマイシン 200mg(力価) ランソプラゾール 30mg | 2回/日 | 87.5% (84/96) | 91.1% (82/90) |
| アモキシシリン水和物 750mg(力価) クラリスロマイシン 400mg(力価) ランソプラゾール 30mg | 2回/日 | 89.2% (83/93) | 83.7% (82/98) |
| 各薬剤の1回投与量 | 投与回数 | 除菌率 胃潰瘍 | 除菌率 十二指腸潰瘍 |
| アモキシシリン水和物 750mg(力価) クラリスロマイシン 200mg(力価) ラベプラゾールナトリウム 10mg | 2回/日 | 87.7% (57/65) | 83.3% (45/54) |
| アモキシシリン水和物 750mg(力価) クラリスロマイシン 400mg(力価) ラベプラゾールナトリウム 10mg | 2回/日 | 89.7% (61/68) | 87.8% (36/41) |