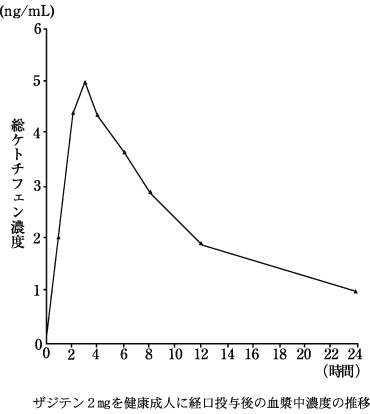
1
Debelic,M.et al.:Dtsch.med.Wschr.106,1704,1981〔ZENM00213〕
2
Le Blaye,I.et al.:Drug Safety 7(5),387,1992〔ZENM01402〕
3
Kennedy,G.R.:Res.Clin.Forums 4(1),17,1982〔ZENM00224〕
4
熊谷 朗ほか:臨床評価 8(2),353,1980〔ZENJ00022〕
5
奥田 稔ほか:耳鼻咽喉科展望 26(S4),347,1983 〔ZENJ00049〕
6
浦上芳達ほか:皮膚 27(4),897,1985〔ZENJ00315〕
7
権東 明ほか:皮膚 27(3),623,1985〔ZENJ00297〕
8
渡辺加代子ほか:皮膚 27(3),635,1985〔ZENJ00298〕
9
久木田 淳ほか:西日本皮膚科 48(2),333,1986〔ZENJ00379〕
10
Martin,U.et al.:Arzneim.-Forsch.Drug Res.28(5),770,1978〔ZENM00019〕
11
赤星吉徳ほか:アレルギーの臨床 5(5),401,1985〔ZENJ00210〕
12
熊谷 朗ほか:メディカルサンド 8(2),87,1980〔ZENJ00016〕
13
岸本真知子ほか:アレルギーの臨床 4(2),149,1984〔ZENJ00110〕
14
Ney,U.M.et al.:Res.Clin.Forums 4(1),9,1982〔ZENM0106C〕
15
Mazzoni,L.et al.:Br.J.Pharmacol.86(Proc.Suppl.),571,1985〔ZENM00618〕
16
Morley,J.et al.:Agents.Actions.Suppl.23,187,1988〔ZENM01112〕
17
Arnoux,B.et al.:Am.Rev.Respir.Dis.137(4),855,1988〔ZENM00894〕
18
Podleski,W.K.et al.:Agents.Actions.15(3-4),177,1984〔ZENM00523〕
19
宮里 稔ほか:炎症 8(3),260,1988〔ZENJ00789〕
20
笹本明義ほか:小児科臨床 39(11),3275,1986〔ZENJ00442〕
21
碇 久雄ほか:小児科臨床 42(3),589,1989〔ZENJ00906〕
22
伊藤和彦ほか:薬理と治療 8(2),563,1980〔ZENJ00018〕
23
山田政功ほか:アレルギーの臨床 4(2),137,1984〔ZENJ00104〕
24
臼井信郎ほか:耳鼻咽喉科展望 27(S1),107,1984〔ZENJ00114〕
25
田中憲雄ほか:臨牀と研究 57(8),2712,1980〔ZENJ00021〕
26
Giesen,H.K.et al.:Med.Welt 30(37),1359,1979〔ZENM00052〕