1
Bjørk MH, et al. : JAMA Neurol. 2022; 79: 672-681
2
Dreier JW, et al. : JAMA Neurol. 2023; 80: 568-577
3
大塚頌子ほか : てんかん研究. 2014; 32: 13-24
4
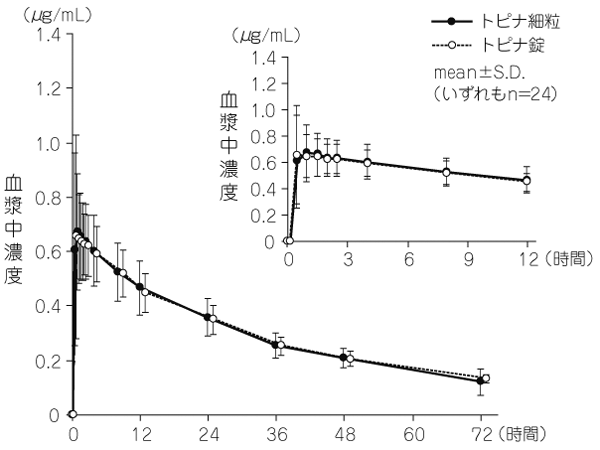
社内資料:細粒剤と錠剤の生物学的同等性試験(2013年11月22日承認、CTD2.7.6.2)
5
社内資料:バイオアベイラビリティ(健康成人・外国人)(2007年7月31日承認、CTD2.5.2.3)
6
社内資料:食事の影響試験(2007年7月31日承認、CTD2.5.2.4)
7
大岩弘幸ほか : 薬理と治療. 2008; 36: 493-499
8
松田一己ほか : 新薬と臨床. 2007; 56: 1385-1403
9
大沼悌一ほか : 新薬と臨床. 2007; 56: 1659-1681
10
大塚頌子 : てんかん研究. 2013; 31: 19-29
11
社内資料:部分発作を有する小児てんかん患者の長期投与試験(2013年11月22日承認、CTD2.7.6.7)
12
DeLorenzo RJ, et al. : Epilepsia. 2000; 41(Suppl.1): S40-S44
13
Zhang X, et al. : Epilepsia. 2000; 41(Suppl.1): S52-S60
14
Gibbs JW 3rd, et al. : Epilepsia. 2000; 41(Suppl.1): S10-S16
15
White HS, et al. : Epilepsy Res. 1997; 28: 167-179
16
Dodgson SJ, et al. : Epilepsia. 2000; 41(Suppl.1): S35-S39
17
Shank RP, et al. : Epilepsia. 1994; 35: 450-460
18
Wauquier A, et al. : Epilepsy Res. 1996; 24: 73-77
19
Kanda T, et al. : Life Sci. 1996; 59: 1607-1616
20
Nakamura J, et al. : Eur J Pharmacol. 1994; 254: 83-89
21
Edmonds HL Jr, et al. : Life Sci. 1996; 59: PL127-PL131
22
Koh S, et al. : Ann Neurol. 2001; 50: 366-372