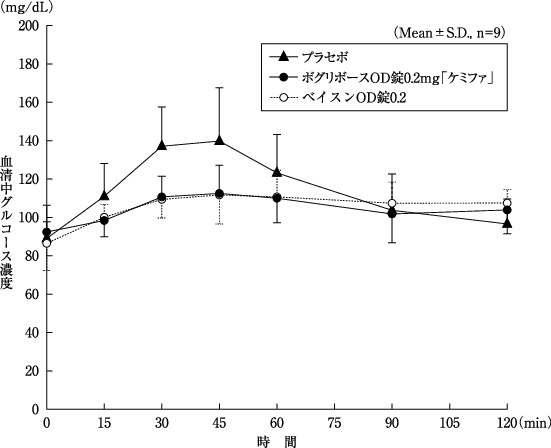
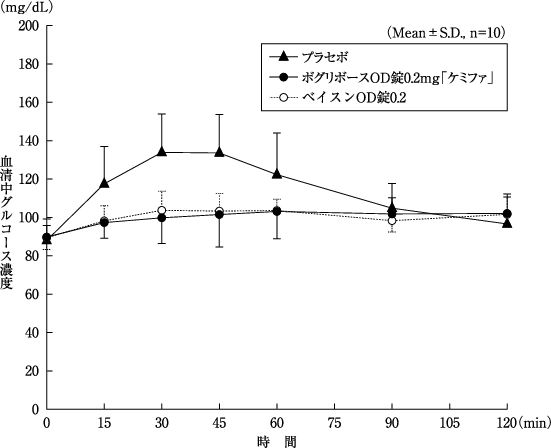
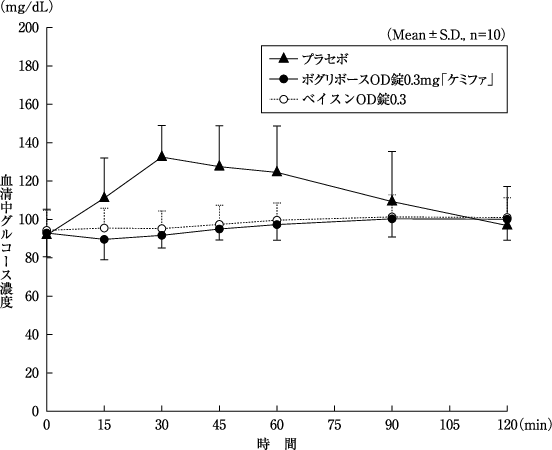
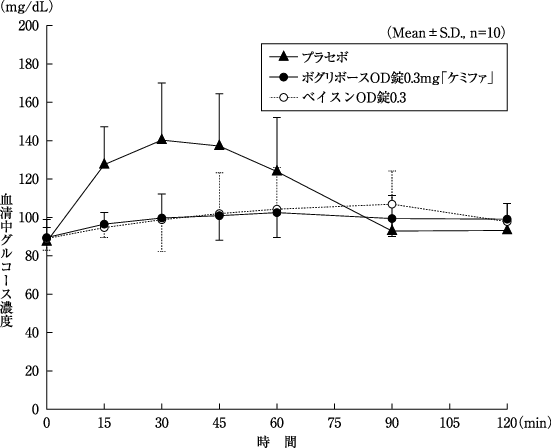
1
Morseth S.L. et al.:薬理と治療. 1991;19:4325-4340
2
Morseth S.L. et al.:薬理と治療. 1991;19:4375-4396
3
平賀興吾:基礎と臨床. 1992;26:283-294
4
前芝良宏 他:薬理と治療. 1991;19:3639-3649
5
後藤由夫 他:医学のあゆみ. 1992;160:943-971
6
神谷文雅 他:臨床成人病. 1992;22:573-591
7
池田義雄 他:新薬と臨牀. 1992;41:20-28
8
中埜幸治 他:診療と新薬. 1991;28:2315-2323
9
森島豊彦 他:臨牀と研究. 1992;69:3997-4010
10
河盛隆造 他:糖尿病. 1992;35:633-640
11
柴田 昭 他:Progress in Medicine. 1992;12:239-250
12
田港朝彦 他:新薬と臨牀. 1992;41:193-205
13
西澤良記 他:医学と薬学. 1992;27:123-135
14
松岡 瑛 他:診療と新薬. 1992;29:255-265
15
加来浩平 他:薬理と治療. 1992;20:887-899
16
三村和郎 他:臨牀と研究. 1992;69:919-932
17
三村和郎 他:臨牀と研究. 1992;69:235-244
18
中村光男 他:新薬と臨牀. 1992;41:2-18
19
小泉順二 他:診療と新薬. 1992;29:241-252
20
梅田文夫 他:臨牀と研究. 1992;69:1309-1322
21
Kawamori R. et al:Lancet. 2009;373:1607-1614
22
臨床に関する資料(ii)有効性及び安全性試験成績の概要(ベイスンOD錠:2004年2月25日承認、審査報告書)
23
小高裕之 他:日本栄養・食糧学会誌. 1992;45:27-31
24
後藤由夫 他:臨床成人病. 1992;22:451-458
25
池田 衡 他:薬理と治療. 1991;19:4105-4117
26
Odaka H. et al.:J.Nutr.Sci.Vitaminol. 1992;38:27-37
27
池田 衡 他:薬理と治療. 1991;19:4451-4456
28
小高裕之 他:日本栄養・食糧学会誌. 1992;45:33-38
29
高見健治 他:薬理と治療. 1991;19:4457-4467
30
小高裕之 他:薬理と治療. 1991;19:4829-4834
31
シオノケミカル株式会社:生物学的同等性に関する資料(社内資料)