1
Morseth, S. L. et al.:薬理と治療, 1991;19:4325-4340
2
Morseth, S. L. et al.:薬理と治療, 1991;19:4375-4396
3
平賀興吾:基礎と臨床, 1992;26:283-294
4
前芝良宏他:薬理と治療, 1991;19:3639-3649
5
後藤由夫他:医学のあゆみ, 1992;160:943-971
6
神谷文雅他:臨床成人病, 1992;22:573-591
7
池田義雄他:新薬と臨牀, 1992;41:20-28
8
中埜幸治他:診療と新薬, 1991;28:2315-2323
9
森島豊彦他:臨牀と研究, 1992;69:3997-4010
10
河盛隆造他:糖尿病, 1992;35:633-640
11
柴田昭他:Progress in Medicine, 1992;12:239-250
12
田港朝彦他:新薬と臨牀, 1992;41:193-205
13
西澤良記他:医学と薬学, 1992;27:123-135
14
松岡瑛他:診療と新薬, 1992;29:255-265
15
加来浩平他:薬理と治療, 1992;20:887-899
16
三村和郎他:臨牀と研究, 1992;69:919-932
17
三村和郎他:臨牀と研究, 1992;69:235-244
18
中村光男他:新薬と臨牀, 1992;41:2-18
19
小泉順二他:診療と新薬, 1992;29:241-252
20
梅田文夫他:臨牀と研究, 1992;69:1309-1322
21
Kawamori, R. et al.:Lancet, 2009;373:1607-1614
22
国内第Ⅲ相試験(ベイスン錠/OD錠:2009年10月16日承認、申請資料概要2.7.4.2, 2.7.6.2)
23
小高裕之他:日本栄養・食糧学会誌, 1992;45:27-31
24
後藤由夫他:臨床成人病, 1992;22:451-458
25
池田衡他:薬理と治療, 1991;19:4105-4117
26
Odaka, H. et al.:J. Nutr. Sci. Vitaminol., 1992;38:27-37
27
池田衡他:薬理と治療, 1991;19:4451-4456
28
小高裕之他:日本栄養・食糧学会誌, 1992;45:33-38
29
高見健治他:薬理と治療, 1991;19:4457-4467
30
小高裕之他:薬理と治療, 1991;19:4829-4834
31
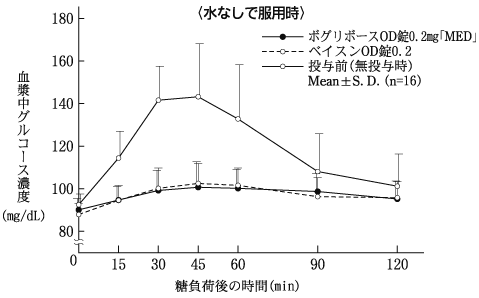
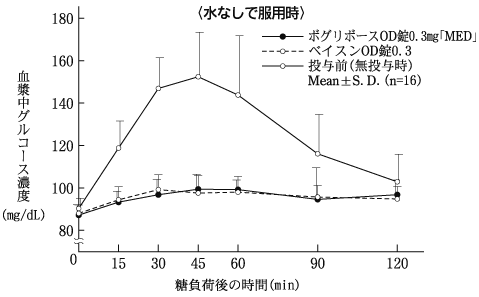
社内資料:生物学的同等性試験