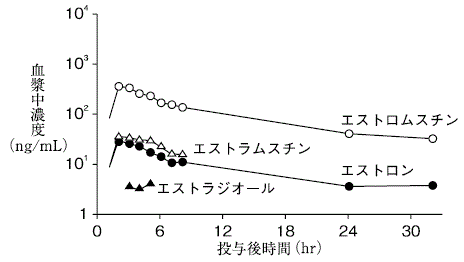
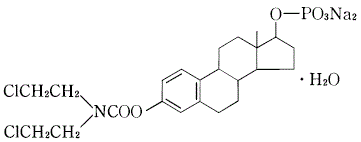
1
Gunnarsson PO, et al. : Urology. 1984;23(6):22-7
2
Norlen BJ, et al. : J Urol. 1988;140:1058-63
3
Kadohama N, et al. : New York State J Med. 1979;79:1005-9
4
Dixon R, et al. : Res Comm Chem Pathol Pharm. 1980;27(1):17-29
5
Forshell GP, et al. : Invest Urol. 1976;14(2):128-31
6
高安久雄ほか:西日泌尿. 1980;42(4):715-31
7
Watanabe H, et al. : The Prostate. 1981;2:155-61
8
高安久雄ほか:西日泌尿. 1982;44(3):889-99
9
Wakisaka M, et al. : Urol Res. 1979;7: 291-8
10
Fredholm B, et al. : Acta Pharmacol Toxicol. 1974;35 suppl. 1: 28
11
尾崎正邦ほか:薬理と治療. 1980;8(10):3707-10
12
佐藤 博:薬理と治療. 1980;8(10):3695-9
13
由井康雄:日泌尿会誌. 1979;70(1):28-45
14
岡田謙一郎ほか:泌尿紀要. 1981;27(5):565-75
15
Muntzing J, et al. : Urology. 1977;10(5):439-45
16
Hartley-Asp B, : The Prostate. 1984;5:93-100
17
Yamanaka H, et al.:Invest Urol. 1977;14(5):400-4
18
山中英寿ほか:ホルモンと臨床. 1981;29(4):477-85
19
高橋秀寿ほか:日大医誌. 1980;39(12):975-81



 401
401