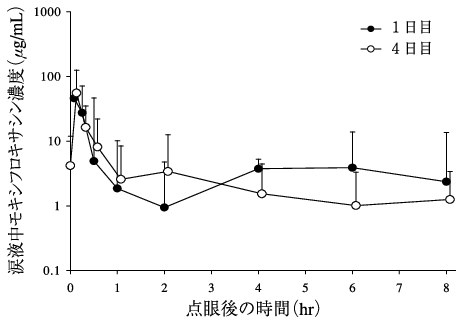
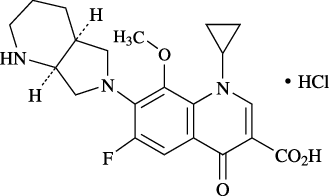
1
社内資料:日本人及び外国人健康成人を対象とした第Ⅰ相薬物動態試験(1日3回点眼)(治験No.C-06-16)(2006年7月26日承認、CTD2.7.6(1)1))[20170299]
2
社内資料:日本人健康成人を対象とした第Ⅰ相薬物動態検討試験(1日8回点眼)(治験No.C-06-22)(2006年7月26日承認、CTD2.7.6(1)2))[20170300]
3
社内資料:外国人健康成人を対象とした海外第Ⅰ相涙液薬物動態試験(治験No.C-06-53)(2006年7月26日承認、CTD2.7.6(1)3))[20170306]
4
社内資料:ウサギにおける単回点眼後の眼組織未変化体濃度(2006年7月26日承認、CTD2.6.4.4(1)1))[20170312]
5
岡本茂樹 他:あたらしい眼科. 2007;24(12):1661-1674[20161013]
6
下村嘉一 他:あたらしい眼科. 2007;24(10):1381-1394[20161014]
7
松本光希 他:あたらしい眼科. 2007;24(10):1395-1405[20161015]
8
吉田博則 他:あたらしい眼科. 2007;24(12):1675-1683[20161016]
9
Maxwell A, et al.:Mode of action. In:Kuhlmann J, Dalhoff A,Zeiler H-J, editors. Quinolone Antibacterials. Berlin:Springer Verlag 1998;119-166[20161017]
10
Schedletzky H, et al.:J. Antimicrob. Chemother. 1999;43(Suppl B), 31-37[20161018]
11
Thibodeaux BA, et al.:Curr. Eye Res. 2004;28(5), 337-342[20161019]
12
Dajcs JJ, et al.:Antimicrob. Agents Chemother. 2004;48(6), 1948-1952[20161020]