1
社内資料:授乳婦における薬物動態と乳汁移行(承認年月日:2006年7月26日、CTD2.7.6)
2
社内資料:制酸剤との薬物相互作用(承認年月日:2006年7月26日、CTD2.7.2.2)
3
Eckhardt, K. et al.:Anesth Analg.2000;91(1):185-191
4
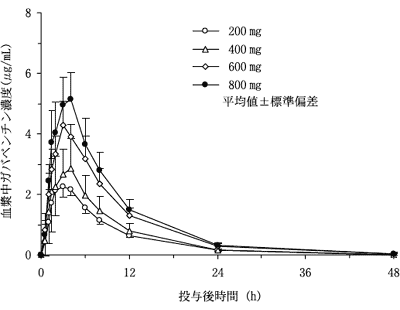
社内資料:健康成人における単回投与時の安全性と薬物体内動態(承認年月日:2006年7月26日、CTD2.7.2.2)
5
社内資料:健康成人における反復投与時の安全性と薬物動態(1800mg/日)(承認年月日:2006年7月26日、CTD2.7.2.2)
6
社内資料:健康成人における反復投与時の安全性と薬物動態(2400mg/日)(承認年月日:2006年7月26日、CTD2.7.4.2.2)
7
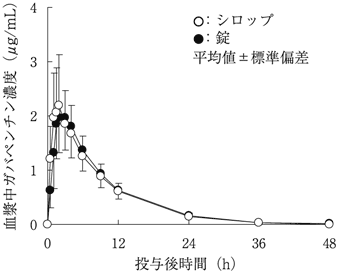
社内資料:生物学的同等性ならびに食事の影響(シロップ剤)(承認年月日:2011年7月1日、CTD2.7.1.2.1.1)
8
社内資料:生物学的同等性ならびに食事の影響(錠剤)(承認年月日:2006年7月26日、CTD2.7.1.2)
9
社内資料:バイオアベイラビリティ(承認年月日:2006年7月26日、CTD2.7.1.2)
10
社内資料:放射性標識体投与時の薬物動態及び代謝(承認年月日:2006年7月26日、CTD2.7.6)
11
社内資料:脳脊髄液移行及び薬物動態(承認年月日:2006年7月26日、CTD2.5.3)
12
社内資料:蛋白結合(承認年月日:2006年7月26日、CTD2.6.4.4)
13
社内資料:アンチピリンのクリアランスに対する作用(薬物代謝酵素誘導)(承認年月日:2006年7月26日、CTD2.7.6)
14
社内資料:ヒトcytochrome P450に対する阻害作用(承認年月日:2006年7月26日、CTD2.7.2.2)
15
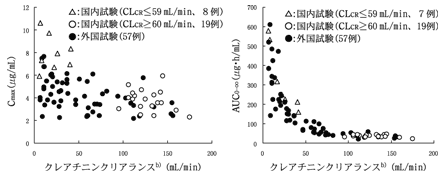
社内資料:腎機能障害患者における薬物動態(承認年月日:2006年7月26日、CTD2.7.2.2)
16
社内資料:健康被験者、腎機能障害及びてんかん患者における母集団薬物動態(承認年月日:2006年7月26日、CTD2.7.2.3)
17
社内資料:血液透析患者における薬物動態(承認年月日:2006年7月26日、CTD2.7.2.2)
18
社内資料:腎機能低下患者における薬物動態
19
社内資料:高齢者における薬物動態(承認年月日:2006年7月26日、CTD2.7.2.2)
20
社内資料:フェニトインとの薬物相互作用(承認年月日:2006年7月26日、CTD2.7.2.2)
21
社内資料:カルバマゼピンとの薬物相互作用(承認年月日:2006年7月26日、CTD2.7.2.2)
22
社内資料:バルプロ酸との薬物相互作用(承認年月日:2006年7月26日、CTD2.7.2.2)
23
社内資料:フェノバルビタールとの薬物相互作用(承認年月日:2006年7月26日、CTD2.7.2.2)
24
社内資料:プロベネシドとの薬物相互作用(承認年月日:2006年7月26日、CTD2.7.2.2)
25
社内資料:シメチジンとの薬物相互作用(承認年月日:2006年7月26日、CTD2.7.2.2)
26
社内資料:経口避妊薬との薬物相互作用(承認年月日:2006年7月26日、CTD2.7.2.2)
27
社内資料:ナプロキセンとの薬物相互作用(承認年月日:2006年7月26日、CTD2.7.2.2)
28
社内資料:成人における二重盲検法による難治てんかん(部分発作)に対する有効性及び安全性(承認年月日:2006年7月26日、CTD2.7.6)
29
社内資料:成人における長期投与時の有効性及び安全性(第Ⅱ相試験からの移行症例)(承認年月日:2006年7月26日、CTD2.7.6)
30
社内資料:成人における長期投与時の有効性及び安全性(第Ⅲ相試験からの移行症例)(承認年月日:2006年7月26日、CTD2.7.6)
31
社内資料:小児における非盲検法による難治てんかん(部分発作)に対する有効性及び安全性(承認年月日:2006年7月26日、CTD2.7.3.2.1)
32
社内資料:小児における長期投与時の有効性及び安全性(承認年月日:2006年7月26日、CTD2.7.3.2.2)
33
Gee, N.S. et al.:J Biol Chem.1996;271(10):5768-5776
34
Fink, K. et al.:Br J Pharmacol.2000;130(4):900-906
35
Petroff, O.A.C. et al.:Epilepsia.2000;41(6):675-680
36
社内資料:非臨床薬理(承認年月日:2006年7月26日、CTD2.6.2.2、2.6.2.5)