1
花岡一雄 他:臨床薬理, 1983;14(4):573-591
2
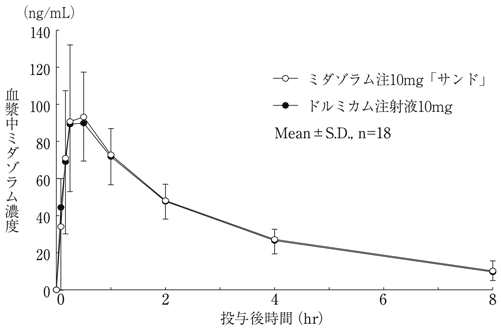
社内資料:生物学的同等性試験(ミダゾラム注10mg「サンド」)
3
Amerein,R.et al.:Acta Anaesthesiol Scand., 1990;92(Suppl.):6-15
4
Wilson,C.M.et al.:Anaesthesia, 1987;42(10):1057-1062
5
Wilson,C.M.et al.:Ir. J. Med. Sci., 1986;155(9):322
6
Nitsun,M.et al.:Clin Pharmacol Ther., 2006;79(6):549-557
7
Koitabashi,T.et al.:J Anesth., 1997;11(3):242-243
8
Kronbach,T.et al.:Mol. Pharmacol., 1989;36(1):89-96
9
Blumenthal,P.et al.:J. Clin. Pharmacol., 1984;24:400
10
Vinik,H.R.et al.:Anesthesiology, 1983;59(5):390-394
11
MacGilchrist,A.J.et al.:Gut, 1986;27:190-195
12
Blumer,J.L.:Clin. Pharmacokinet., 1998;35(1):37-47
13
Burtin,P.et al.:Clin. Pharmacol. Ther., 1994;56:615-625
14
Greenblatt,D.J.et al.:Anesthesiology, 1984;61(1):27-35
15
Holazo,A.A.et al.:J. Clin. Pharmacol., 1988;28(11):1040-1045
16
Kinoshita,K.et al.:J. Int. Med. Res., 2001;29(4):342-348
17
Tsutsumi,K.et al.:J. Int. Med. Res., 2001;29(4):335-341
18
持続静脈内投与時の薬物動態(ドルミカム注 2000年7月25日承認 審査報告書p.8)
19
百瀬 隆 他:臨床医薬, 1985;1(2):281-291
20
百瀬 隆 他:臨床医薬, 1985;1(3):407-425
21
百瀬 隆 他:臨床医薬, 1985;1(10):1399-1411
22
花岡一雄 他:日本臨床麻酔学会誌, 1985;5(3):333-342
23
Hanaoka,K.et al.:Crit. Care Med., 2002;30(6):1256-1260
24
花岡一雄 他:麻酔と蘇生, 2002;38(3):163-171
25
髙折修二他監訳:グッドマン・ギルマン薬理書・第12版[上巻], 2013;568-575
26
Costa,E.:Life Sci , 1988;42(15):1407-1417
27
矢島 孝 他:薬理と治療, 1985;13:1061-1089
28
鈴木雅徳 他:応用薬理, 1999;58(2):45-51