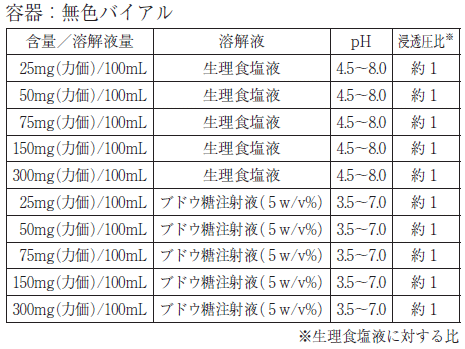
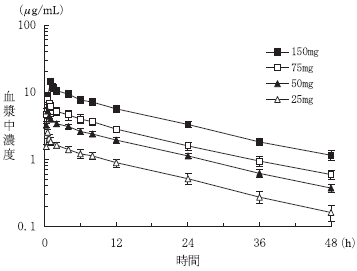
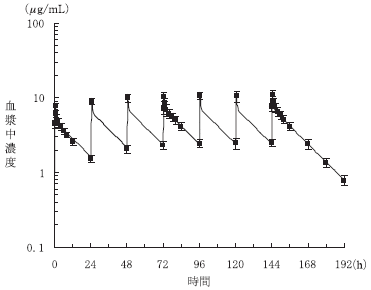
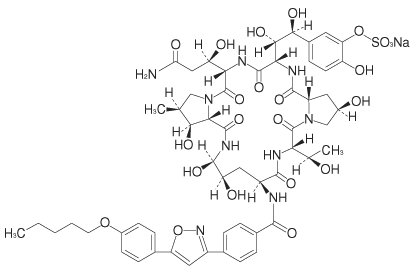
1
社内報告書:海外健康成人・薬物相互作用試験(2006年4月20日承認 CTD 2.7.4.5.3)(DIR110045)
2
社内報告書:ラット・毒性試験(2002年10月8日承認 申請資料概要ニ.2.1))(DIR020071)
3
社内報告書:ラット・毒性試験(2002年10月8日承認 申請資料概要ニ.2.6))(DIR020073)
4
社内報告書:ラット・毒性試験(2002年10月8日承認 申請資料概要ニ.2.5))(DIR020075)
5
社内報告書:ラット・毒性試験(2002年10月8日承認 申請資料概要ニ.9.1))(DIR020077)
6
社内報告書:ラット・毒性試験(2007年1月26日承認 CTD 2.6.6.8.1)(DIR060215)
7
社内報告書:ラット・毒性試験(2007年1月26日承認 CTD 2.6.6.8.1)(DIR060214)
8
社内報告書:ビーグル犬・毒性試験(2002年10月8日承認 申請資料概要ニ.2.9)、ニ.9.5))(DIR020079)
9
社内報告書:ラット・毒性試験(2002年10月8日承認 申請資料概要ニ.3.1))(DIR020081)
10
二木芳人 他:日本化学療法学会雑誌2002;50(S-1):58-67[FUN-00121]
11
東 純一 他:日本化学療法学会雑誌2002;50(S-1):155-184[FUN-00129]
12
社内報告書:深在性真菌症患者・薬物動態(DIR020062)
13
社内報告書:移植患者・薬物動態(DIR020063)
14
社内報告書:移植患者・薬物動態(DIR020064)
15
社内報告書:ラット・薬物動態(DIR020070)
16
社内報告書:健康成人・薬物動態(DIR020065)
17
社内報告書:ヒト肝ミクロソーム・代謝(DIR020066)
18
社内報告書:ラット及びヒト・代謝(DIR020067)
19
社内報告書:in vitro・代謝(DIR020068)
20
社内報告書:健康成人・薬物動態(DIR020069)
21
社内報告書:深在性真菌症小児患者・薬物動態(DIR060001)
22
社内報告書:深在性真菌症低出生体重児患者・薬物動態(DIR060002)
23
東 純一 他:日本化学療法学会雑誌2002;50(S-1):148-154[FUN-00128]
24
山口英世 他:日本化学療法学会雑誌 2002;50(S-1):20-29[FUN-00115]
25
Tawara, S. et al.:Antimicrob. Agents Chemother. 2000;44(1):57-62[FUN-00003]
26
Uchida, K. et al.:J.Antibiotics 2000;53(10):1175-1181[FUN-00009]
27
池田文昭 他:日本化学療法学会雑誌 2002;50(S-1):8-19[FUN-00114]
28
Ikeda, F. et al.:Antimicrob. Agents Chemother. 2000;44(3):614-618[FUN-00004]
29
松本 哲 他:日本化学療法学会雑誌 2002;50(S-1):30-36[FUN-00116]
30
Maesaki, S. et al.:Antimicrob. Agents Chemother. 2000;44(6):1728-1730[FUN-00006]
31
中井 徹 他:日本化学療法学会雑誌 2002;50(S-1):48-53[FUN-00119]
32
Matsumoto, S. et al.:Antimicrob. Agents Chemother. 2000;44(3):619-621[FUN-00005]
33
松本 哲 他:日本化学療法学会雑誌 2002;50(S-1):37-42[FUN-00117]
34
Garcia-Effron, G. et al.:Antimicrob. Agents Chemother. 2009;53(1):112-122[FUN-01687]
35
Garcia-Effron, G. et al.:Antimicrob. Agents Chemother. 2009;53(9):3690-3699[FUN-01809]
36
Castanheira, M. et al.:Antimicrob. Agents Chemother. 2010;54(6):2655-2659[FUN-01955]
37
Beyda, N. D. et al.:Ann. Pharmacother. 2012;46(7-8):1086-1096[FUN-02779]