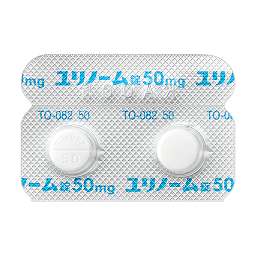
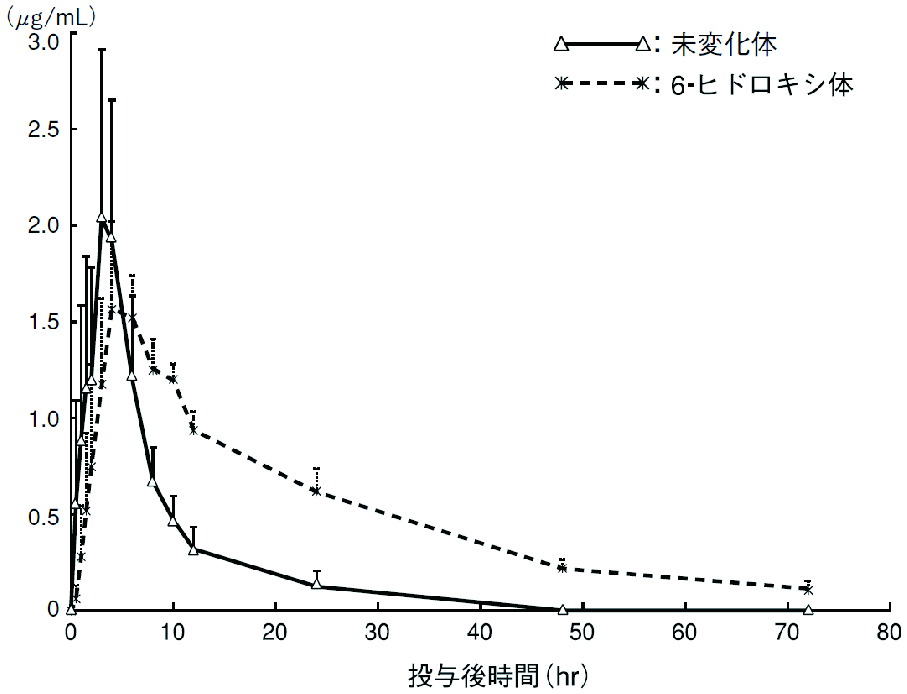
1
及川寿浩ほか:新薬と臨床.2004;53(6):682-691
2
及川寿浩ほか:痛風と核酸代謝.2011;35(1):19-30
3
Walter-Sack I,et al.:Eur J Med Res.1998;3(1-2):45-49
4
中村徹ほか:リウマチ.1971;11(4):342-348
5
Politta G,et al.:Schweiz Rundschau Med(Praxis).1973;62(44):1345-1350
6
Enomoto A,et al.:Nature.2002;417(6887):447-452
7
及川寿浩ほか:新薬と臨床.2005;54(6):645-650