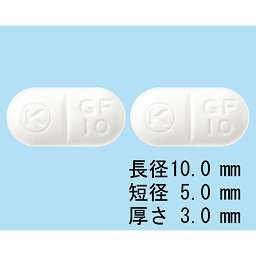
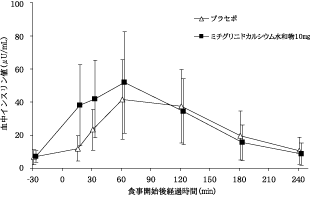
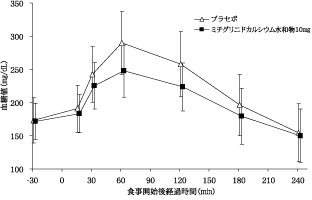
1
社内資料:健康成人を対象とした臨床薬理試験(2004年1月29日承認、申請資料概要 ヘ.3.1.2)[文献参照番号][44004]
2
社内資料:健康成人を対象とした臨床薬理試験(2004年1月29日承認、申請資料概要 ヘ.3.1.2)[文献参照番号][44004]
3
中野祐樹ほか:薬理と治療.2016;44(1):57-64.[文献参照番号][86023]
4
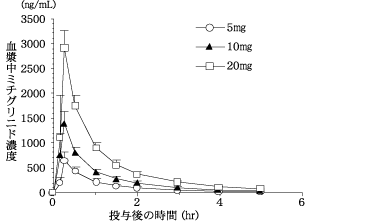
社内資料:健康成人を対象とした第I相臨床試験(2004年1月29日承認、申請資料概要 ヘ.3.1.2)[文献参照番号][44005]
5
社内資料:健康成人を対象とした臨床薬理試験(2004年1月29日承認、申請資料概要 ヘ.3.1.2)[文献参照番号][44004]
6
社内資料:健康成人を対象とした海外臨床薬理試験(2004年1月29日承認、申請資料概要 ヘ.3.5.2)[代謝物の検討][文献参照番号][44007]
7
社内資料:ミチグリニド代謝に関与するUGT分子種(2004年1月29日承認、申請資料概要 ヘ.2.3.3)[文献参照番号][44009]
8
社内資料:ミチグリニド代謝に関与するチトクロームP450分子種(2004年1月29日承認、申請資料概要 ヘ.2.3.4)[文献参照番号][44010]
9
社内資料:健康成人を対象とした海外臨床薬理試験(2004年1月29日承認、申請資料概要 ヘ.3.5.2)[薬物動態と排泄の検討][文献参照番号][44008]
10
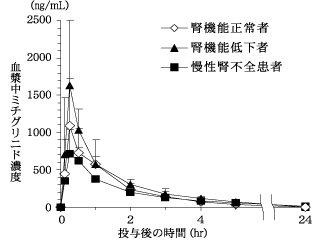
社内資料:腎機能低下者を対象とした臨床薬理試験(2004年1月29日承認、申請資料概要 ヘ.3.3.2)[文献参照番号][44006]
11
社内資料:健康成人を対象とした臨床薬理試験(2004年1月29日承認、申請資料概要 ヘ.3.1.4)[文献参照番号][44018]
12
陶易王ほか:薬理と治療.2007;35(suppl.1):39-49.[文献参照番号][56841]
13
社内資料:健康成人男性を対象とした臨床薬理試験[文献参照番号][60580]
14
社内資料:健康成人を対象とした臨床薬理試験-メトホルミンとの薬物相互作用試験[文献参照番号][86544]
15
社内資料:健康成人を対象とした臨床薬理試験-シタグリプチンとの薬物相互作用試験[文献参照番号][86546]
16
社内資料:2型糖尿病患者を対象とした第III相臨床試験(2004年1月29日承認、申請資料概要 ト.1.3.1)[文献参照番号][44012]
17
社内資料:2型糖尿病患者を対象とした長期投与試験(2004年1月29日承認、申請資料概要ト.1.5.1)[文献参照番号][44013]
18
加来浩平ほか:薬理と治療.2007;35(suppl.1):51-72 [文献参照番号][56842]
19
社内資料:2型糖尿病患者を対象とした長期併用投与試験(ボグリボース)[文献参照番号][000165]
20
社内資料:2型糖尿病患者を対象とした併用投与試験-第II/III 相臨床試験-(ピオグリタゾン)[文献参照番号][60578]
21
社内資料:2型糖尿病患者を対象とした長期併用投与試験(ピオグリタゾン)[文献参照番号][60579]
22
社内資料:2型糖尿病患者を対象とした長期併用投与試験(ビグアナイド系薬剤・DPP-4阻害剤)[文献参照番号][000167]
23
社内資料:グルファスト錠とインスリン製剤の併用に関する製造販売後臨床試験[文献参照番号][000168]
24
Ohnota,H.et al.:J.Pharmacol.Exp.Ther.1994;269(2):489-495.[文献参照番号][22539]
25
Ichikawa,K.et al.:Arzneim.-Forsch./Drug Res.2002;52(8):605-609.[文献参照番号][39444]
26
Sunaga,Y.et al.:Eur.J.Pharmacol.2001;431(1):119-125.[文献参照番号][36017]
27
社内資料:2型糖尿病患者を対象とした第II相臨床試験(2004年1月29日承認、申請資料概要 ト. 1.2.3)[文献参照番号][44014]
28
Ichikawa,K.et al.:Clin.Exp.Pharmacol.Physiol.2002;29(5-6):423-427.[文献参照番号][38496]
29
生島一真ほか:薬理と治療.2004;32(2):73-80.[文献参照番号][45450]