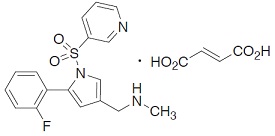
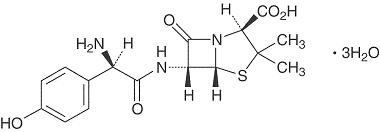
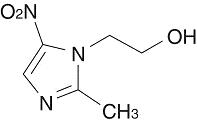
1
Somogyi A, et al. Eur J Clin Pharmacol. 1983;25:683-687.
2
Kafetzis D.K, et al. Acta Peadiatr Scand.1981;70:285.
3
Rustia M, et al. J Natl Cancer Inst. 1972;48:721-729.
4
Roe FJC, et al. Surgery. 1983;93:158-164.
5
Rustia M, et al. J Natl Cancer Inst. 1979;63:863-868.
6
ボノプラザンの薬物動態試験成績⑫(タケキャブ錠2014年12月26日承認:CTD 2.7.6.12)
7
Gray MS. J Obstet Gynaecol Br Commonw. 1961;68:723-729.
8
Gray MS. Br J Vener Dis. 1961;37:278-279.
9
ボノプラザンの薬物動態試験成績⑨(タケキャブ錠2014年12月26日承認:CTD 2.7.6.10)
10
ボノプラザンの薬物動態試験成績⑩(タケキャブ錠2014年12月26日承認:CTD 2.7.6.9)
11
ボノプラザンの薬物動態試験成績⑭(社内資料)
12
ボノプラザンの臨床試験成績⑩(タケキャブ錠2014年12月26日承認:CTD 2.7.6.19)
13
上田泰, 他編. 感染症学-基礎と臨床. メジカルビュー社. 1982:204.
14
ボノプラザンの薬理試験成績(タケキャブ錠2014年12月26日承認:CTD 2.6.2.6)
15
Osato MS. Curr Pharm Des. 2000;6:1545-1555.
16
山本達男, 他. 日本臨牀. 2005;63(S-11):376-381.
17
Upcroft P, et al. Clin Microbiol Rev. 2001;14:150-164.






 640
640
 763
763