1
Rustia M. et al.: J. Natl. Cancer Inst., 1972;48(3):721-729 [PRT-1062]
2
Roe F. J. C. et al.: Surgery, 1983;93(1):158-164 [PRT-1063]
3
Rustia M. et al.: J. Natl. Cancer Inst., 1979;63(3):863-868 [PRT-1064]
4
Somogyi A. et al.: Eur. J. Clin. Pharmacol., 1983;25(5):683-687 [PRT-1376]
5
楠信男ら:Chemotherapy, 1978;26(3):311-316 [PRT-1056]
6
Gray M. S.: J. Obstet. Gynaecol. Br. Commonw., 1961;68(5):723-729 [PRT-1065]
7
古谷博ら:Chemotherapy, 1973;21(8):1752-1758 [PRT-1059]
8
青河寛次ら:Chemotherapy, 1973;21(8):1780-1786 [PRT-1060]
9
Gray M. S. et al.: Br. J. Vener. Dis., 1961;37(4):278-279 [PRT-1066]
10
Isomoto H. et al.: Aliment. Pharmacol. Ther., 2003;18(1):101-107 [PRT-0340]
11
Osato M. S.: Curr. Pharm. Des., 2000;6(15):1545-1555 [PRT-1067]
12
山本達男ら:日本臨牀, 2005;63(S.11):376-381 [PRT-1068]
13
Upcroft P. et al.: Clin. Microbiol. Revs., 2001;14(1):150-164 [PRT-1069]



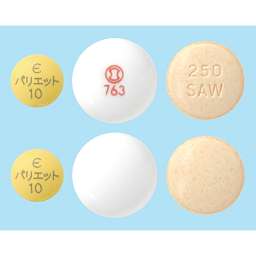



 パリエット10
パリエット10
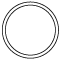
 763
763