1
Mayhew B. S. et al.: Drug Metab. Dispos., 2000;28(9):1031-1037 [PRT-1053]
2
Suzuki A. et al.: Drug Metab. Pharmacokinet., 2003;18(2):104-113 [PRT-1054]
3
厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群 [PRT-1055]
4
楠信男ら:Chemotherapy, 1978;26(3):311-316 [PRT-1056]
5
瀧井昌英ら:Chemotherapy, 1989;37(1):15-21 [PRT-1057]
6
足立暁ら:Chemotherapy, 1988;36(S.3):660-666 [PRT-1058]
7
古谷博ら:Chemotherapy, 1973;21(8):1752-1758 [PRT-1059]
8
青河寛次ら:Chemotherapy, 1973;21(8):1780-1786 [PRT-1060]
9
Kuwayama H. et al.: Aliment. Pharmacol. Ther., 2007;25(9):1105-1113 [PRT-0531]
10
懸川友人ら:Chemotherapy, 1988;36(S.3):123-128 [PRT-1061]





 パリエット10
パリエット10





 パリエット10
パリエット10






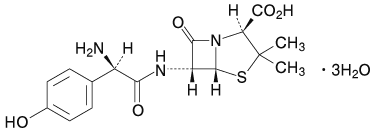
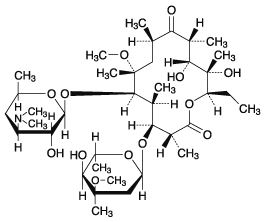 (日局に準拠)
(日局に準拠)

