1
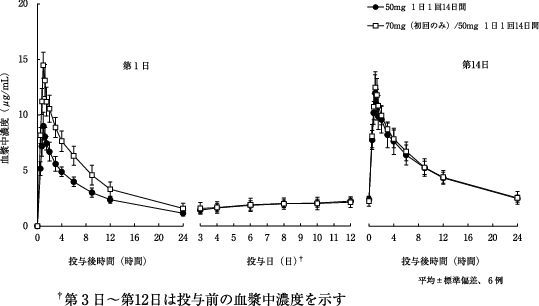
社内資料:健康成人における単回投与試験(2012年1月18日承認、CTD 2.7.2.2)
2
社内資料:健康成人における反復投与試験(2012年1月18日承認、CTD 2.7.2.2)
3
社内資料:深在性真菌症(小児)を対象とした臨床試験(2014年12月18日承認、CTD 2.7.2.2)
4
Li CC et al. Antimicrob Agents Chemother. 2011;55:2098-105.
5
Stone JA et al. Antimicrob Agents Chemother. 2004;48:815-23.
6
Mistry GC et al. J Clin Pharmacol. 2007;47:951-61.
7
社内資料:シクロスポリンとの相互作用(2012年1月18日承認、CTD 2.7.2.2)
8
社内資料:タクロリムスとの相互作用(2012年1月18日承認、CTD 2.7.2.2)
9
Stone JA et al. Antimicrob Agents Chemother. 2004;48:4306-14.
10
社内資料:エファビレンツ、ネビラピン、フェニトイン、デキサメタゾン、カルバマゼピンとの相互作用(2012年1月18日承認、CTD 2.7.2.2)
11
社内資料:イトラコナゾールとの相互作用(2012年1月18日承認、CTD 2.7.2.2)
12
社内資料:アムホテリシンBとの相互作用(2012年1月18日承認、CTD 2.7.2.2)
13
社内資料:ミコフェノール酸モフェチルとの相互作用(2012年1月18日承認、CTD 2.7.2.2)
14
社内資料:ネルフィナビルとの相互作用(2012年1月18日承認、CTD 2.7.2.2)
15
Kohno S et al. Eur J Clin Microbiol Infect Dis. 2013;32:387-97.
16
Walsh TJ et al. N Engl J Med. 2004;351:1391-402.
17
Villanueva A et al. Am J Med. 2002;113:294-9.
18
Mora-Duarte J et al. N Engl J Med. 2002;347:2020-29.
19
Maertens J et al. Clin Infect Dis. 2004;39:1563-71.
20
Maertens J et al. Pediatr Infect Dis J. 2010;29:415-20.
21
Zaoutis TE et al. Pediatrics. 2009;123:877-84.
22
Kartsonis NA et al. Drug Resist Updat. 2003;6:197-218.
23
社内資料:In vitro試験による抗真菌活性(2012年1月18日承認、CTD 2.6.2.2)
24
Bartizal K et al. Antimicrob Agents Chemother. 1997;41:2326-32.
25
Bowman JC et al. Antimicrob Agents Chemother. 2002;46:3001-12.
26
Abruzzo GK et al. Antimicrob Agents Chemother. 2000;44:2310-8.
27
van Vianen W et al. J Antimicrob Chemother. 2006;57:732-40.
28
社内資料:In vivo試験による抗真菌活性(2012年1月18日承認、CTD 2.6.2.2)
29
Abruzzo GK et al. Antimicrob Agents Chemother. 1997;41:2333-8.
30
Pfaller MA et al. J Clin Microbiol. 2011;49:624-9.
31
Pfaller MA et al. J Clin Microbiol. 2013;51:2571-81.
32
Castanheira M et al. Antimicrob Agents Chemother. 2010;54:2655-9.