キャンディン系抗真菌剤
1瓶 2297円
| 有効成分 [1バイアル中] | 添加剤 [1バイアル中] |
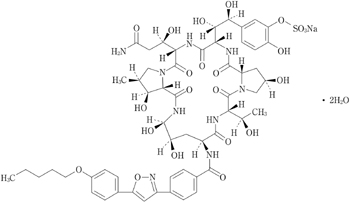
| ミカファンギンナトリウム 50mg(力価) | トレハロース水和物 200mg pH調節剤 |
| 剤形・性状 |
| 白色の塊 用時溶解して用いる注射剤 |
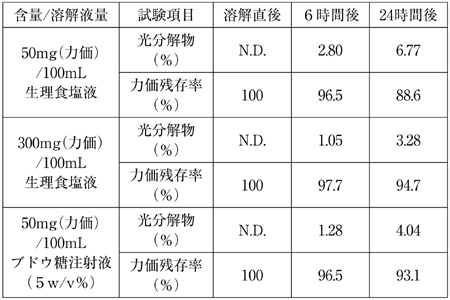
| 含量/溶解液量 | 溶解液 | pH | 浸透圧比 |
| 50mg(力価)/100mL | 生理食塩液 | 4.5〜8.0 | 約1 |
| 75mg(力価)/100mL | 生理食塩液 | 4.5〜8.0 | 約1 |
| 150mg(力価)/100mL | 生理食塩液 | 4.5〜8.0 | 約1 |
| 300mg(力価)/100mL | 生理食塩液 | 4.5〜8.0 | 約1 |
| 50mg(力価)/100mL | ブドウ糖注射液(5w/v%) | 3.5〜7.0 | 約1 |
| 75mg(力価)/100mL | ブドウ糖注射液(5w/v%) | 3.5〜7.0 | 約1 |
| 150mg(力価)/100mL | ブドウ糖注射液(5w/v%) | 3.5〜7.0 | 約1 |
| 300mg(力価)/100mL | ブドウ糖注射液(5w/v%) | 3.5〜7.0 | 約1 |
| 有効成分 [1バイアル中] | 添加剤 [1バイアル中] |
| ミカファンギンナトリウム 75mg(力価) | トレハロース水和物 200mg pH調節剤 |
| 剤形・性状 |
| 白色の塊 用時溶解して用いる注射剤 |
| 含量/溶解液量 | 溶解液 | pH | 浸透圧比 |
| 50mg(力価)/100mL | 生理食塩液 | 4.5〜8.0 | 約1 |
| 75mg(力価)/100mL | 生理食塩液 | 4.5〜8.0 | 約1 |
| 150mg(力価)/100mL | 生理食塩液 | 4.5〜8.0 | 約1 |
| 300mg(力価)/100mL | 生理食塩液 | 4.5〜8.0 | 約1 |
| 50mg(力価)/100mL | ブドウ糖注射液(5w/v%) | 3.5〜7.0 | 約1 |
| 75mg(力価)/100mL | ブドウ糖注射液(5w/v%) | 3.5〜7.0 | 約1 |
| 150mg(力価)/100mL | ブドウ糖注射液(5w/v%) | 3.5〜7.0 | 約1 |
| 300mg(力価)/100mL | ブドウ糖注射液(5w/v%) | 3.5〜7.0 | 約1 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| シロリムス | 本剤との併用によりシロリムスのAUCが21%上昇したとの報告がある。併用する場合は患者の状態を慎重に観察し、シロリムスの副作用発現に注意し必要に応じてシロリムスの投与量を調節すること。 | 機序不明 |
| 頻度不明 | |
| 肝臓 | AST(GOT)上昇、ALT(GPT)上昇、Al-P上昇、LDH上昇、γ-GTP上昇 |
| 代謝異常 | カリウム上昇、カリウム低下、低カルシウム血症、低マグネシウム血症 |
| 血液 | 好酸球増多 |
| 皮膚 | 発疹 |
| 循環器 | 動悸、高血圧 |
| 消化器 | 下痢、悪心、嘔吐、軟便 |
| 腎臓 | BUN上昇、クレアチニン上昇、クレアチニンクリアランス低下 |
| **その他 | 静脈炎、関節炎、悪寒、頭痛、CK(CPK)上昇、発熱、血管痛、ミオグロビン上昇、注射部位反応(腫脹、疼痛、紅斑等) |
| 頻度不明 | |
| 肝臓 | AST(GOT)上昇、ALT(GPT)上昇、Al-P上昇、高ビリルビン血症 |
| 代謝異常 | 低マグネシウム血症、低カルシウム血症、高クロール血症、低カリウム血症 |
| 血液 | 白血球減少、血小板減少、貧血 |
| 皮膚 | 発疹 |
| 循環器 | 血管拡張、高血圧 |
| 消化器 | 嘔吐、嘔気、下痢 |
| 腎臓 | クレアチニン上昇、BUN上昇 |
| その他 | 発熱、腹痛、無力症、さむけ、静脈炎、頭痛 |
| 頻度不明 | |
| 肝臓 | 高ビリルビン血症 |
| 代謝異常 | 低マグネシウム血症、低カリウム血症、低リン酸塩血症 |
| 血液 | 白血球減少 |
| 皮膚 | 発疹 |
| 消化器 | 嘔吐、嘔気、下痢 |
| その他 | 腹痛 |