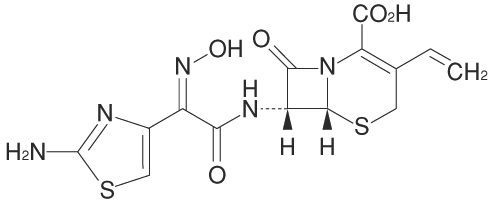
1
厚生労働省健康局結核感染症課編: 抗微生物薬適正使用の手引き[R-07700]
2
島田 馨 他: 日本化学療法学会雑誌 1989; 37(S-2): 208-245[CFN-00031]
3
島田 馨 他: 日本化学療法学会雑誌 1989; 37(S-2): 246-256[CFN-00032]
4
石岡伸一 他: 日本化学療法学会雑誌 1989; 37(S-2): 536-539[CFN-00071]
5
河村正三 他: 日本化学療法学会雑誌 1989; 37(S-2): 1043-1052[CFN-00111]
6
征矢野 薫 他: 日本化学療法学会雑誌 1989; 37(S-2): 1053-1061[CFN-00112]
7
乃木田俊辰 他: 日本化学療法学会雑誌 1989; 37(S-2): 955-969[CFN-00104]
8
佐々木次郎 他: 歯科薬物療法 1992; 11(2): 86-92[CFN-00208]
9
大塚芳基 他: 日本化学療法学会雑誌 1992; 40(10): 1237-1250[CFN-00217]
10
山元貴雄 他: 日本化学療法学会雑誌 1989; 37(S-2): 940-949[CFN-00102]
11
西谷嘉夫 他: 日本化学療法学会雑誌 1989; 37(S-2): 823-840[CFN-00094]
12
Hishida, A. et al.: Antimicrob. Agents Chemother. 1998; 42(7): 1718-1721[CFN-00452]
13
荒田次郎 他: 日本化学療法学会雑誌 1989; 37(S-2): 1016-1042[CFN-00110]
14
原 耕平 他: 日本化学療法学会雑誌 1989; 37(S-2): 634-659[CFN-00080]
15
河田幸道 他: 日本化学療法学会雑誌 1989; 37(S-2): 893-914[CFN-00099]
16
横田 健 他: 日本化学療法学会雑誌 1989; 37(S-2): 16-29[CFN-00017]
17
峯 靖弘 他: 日本化学療法学会雑誌 1989; 37(S-2): 122-134[CFN-00024]
18
井上栄子 他: 日本化学療法学会雑誌 1989; 37(S-2): 1-15[CFN-00016]
19
五島瑳智子 他: 日本化学療法学会雑誌 1989; 37(S-2): 30-55[CFN-00018]
20
加藤直樹 他: 日本化学療法学会雑誌 1989; 37(S-2): 65-76[CFN-00020]
21
西野武志 他: 日本化学療法学会雑誌 1989; 37(S-2): 77-96[CFN-00021]
22
峯 靖弘 他: 日本化学療法学会雑誌 1989; 37(S-2): 100-121[CFN-00023]