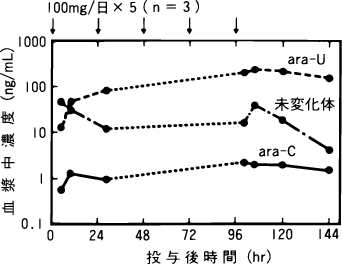
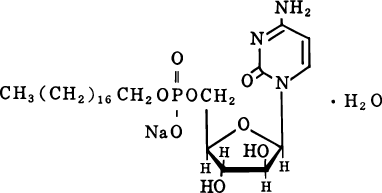
1
福岡正博ほか:癌と化学療法 1990;17:2213-2219
2
巽 典之ほか:癌と化学療法 1990;17:2387-2395
3
Higashigawa M. et al.:Med. Oncol.&Tumor Pharmacother. 1990;7:223-226
4
浴本久雄ほか:癌と化学療法 1990;17:1437-1445
5
浴本久雄ほか:癌と化学療法1990;17:1351-1356
抗悪性腫瘍剤
1カプセル 578.7円
有効成分 | 1カプセル中 シタラビン オクホスファート水和物: 51.5mg 無水物として 50mg |
|---|---|
添加剤 | ヒドロキシプロピルセルロース、D-マンニトール、炭酸ナトリウム、ステアリン酸マグネシウム (カプセル本体) ラウリル硫酸ナトリウム、赤色3号、青色1号 |
有効成分 | 1カプセル中 シタラビン オクホスファート水和物: 103mg 無水物として 100mg |
|---|---|
添加剤 | ヒドロキシプロピルセルロース、炭酸ナトリウム、ステアリン酸マグネシウム (カプセル本体) ラウリル硫酸ナトリウム、赤色3号、青色1号 |
| 剤形 | 白色と赤紫色からなる硬カプセル剤で、内容物は微黄白色の粒状の粉末 |
|---|---|
| 外形 | 表面  裏面  |
| 号数 | 3 |
| 質量 | 0.241g |
| 識別コード | NK7025 |
| 剤形 | 白色と赤紫色からなる硬カプセル剤で、内容物は微黄白色の粒状の粉末 |
|---|---|
| 外形 | 表面  裏面  |
| 号数 | 2 |
| 質量 | 0.331g |
| 識別コード | NK7021 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
抗悪性腫瘍剤 | 骨髄抑制等の副作用が増強することがある。併用療法を行う場合は患者の状態を観察しながら、減量するなど用量に注意すること。 | ともに骨髄抑制作用を有する。 |
10%以上 | 1~10%未満 | 1%未満 | 頻度不明 | |
|---|---|---|---|---|
消化器 | 悪心・嘔吐、食欲不振(35.0%) | 下痢、口内炎 | 下血、黒色便 | 腹痛 |
肝臓 | AST上昇、ALT上昇、LDH上昇、Al-P上昇、総ビリルビン上昇 | γ-GTP上昇 | ||
過敏症 | 発疹 | |||
皮膚 | 脱毛 | |||
泌尿器 | 血尿、BUN上昇、クレアチニン上昇 | |||
その他 | 発熱、倦怠感 | 血清蛋白減少 |