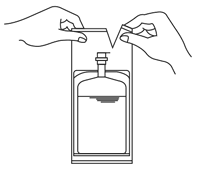
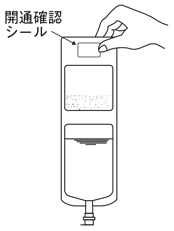
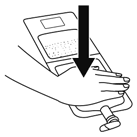
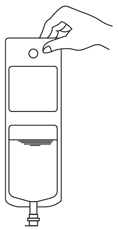
1
厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
2
幸保文治:新薬と臨牀.1999;48(2):133-145
3
幸保文治,et al.:医薬ジャーナル.1987;23(1):157-163
4
幸保文治,et al.:医薬ジャーナル.1986;22(10):129-144
5
幸保文治:新薬と臨牀.2001;50(1):55-75
6
幸保文治:新薬と臨牀.2005;54(7):42-49
7
幸保文治:新薬と臨牀.2006;55(6):44-60
8
第29回日本化学療法学会東日本支部総会新薬シンポジウム,Ceftriaxone,仙台,1982
9
社内資料:小児における単回静脈内投与後の血中濃度及び尿中排泄
10
島田 馨,et al.:Chemotherapy.1984;32(S-7):306-311
11
藤井良知,et al.:Jpn. J. Antibiot.1988;41(9):1237-1250
12
谷村 弘,et al.:Chemotherapy.1984;32(S-7):518-543
13
鈴木啓一郎,et al.:Chemotherapy.1984;32(S-7):500-505
14
本郷基弘,et al.:Jpn. J. Antibiot.1984;37(12):2391-2396
15
土光文夫,et al.:Jpn. J. Antibiot.1984;37(12):2377-2383
16
木下治二,et al.:Chemotherapy.1984;32(S-7):722-739
17
石岡伸一,et al.:Jpn. J. Antibiot.1991;44(6):605-613
18
中村 孝,et al.:Chemotherapy.1984;32(S-7):463-480
19
高瀬善次郎,et al.:Chemotherapy.1984;32(S-7):697-707
20
河村正三,et al.:耳鼻と臨床.1988;34(1):77-86
21
中川千尋,et al.:Jpn. J. Antibiot.1995;48(3):427-431
22
山下敏康,et al.:日本口腔外科学会雑誌.1988;34(11):2343-2350
23
Florence,G,et al.:Biopharm. Drug Dispos.1993;14(2):161-169
24
目黒英典,et al.:小児科臨床.1985;38(2):261-268
25
角田良孝,et al.:化学療法の領域.1989;5(8):1510-1515
26
中島光好,et al.:Chemotherapy.1984;32(S-7):178-196
27
社内資料:疾患別臨床効果集計
28
馬場駿吉,et al.:Jpn. J. Antibiot.1989;42(1):212-247
29
社内資料:単純性肛門性器淋菌感染症に対する用量範囲検討試験
30
社内資料:単純性肛門性器淋菌感染症に対するSPCMを対照薬とした非盲検無作為比較試験
31
社内資料:女性単純性淋菌感染症に対するPCGを対照薬とした非盲検無作為比較試験
32
占部愼二,et al.:Jpn. J. Antibiot.1984;37(11):2169-2173
33
市木康久,et al.:Chemotherapy.1990;38(1):68-73
34
社内資料:女性骨盤内炎症性疾患に対するCFXを対照薬とした非盲検無作為比較試験
35
社内資料:男性単純性淋菌感染症に対するPCGを対照薬とした非盲検無作為比較試験
36
Ronald, M. R.,et al.:Am. J. Obstet. Gynecol.2001;185(3):629-632
37
Portilla, I.,et al.:Sex Transm. Dis.1992;19(2):94-98
38
関根 譲,et al.:Chemotherapy.1984;32(S-7):1-15
39
西野武志,et al.:Chemotherapy.1984;32(S-7):62-76
40
五島瑳智子,et al.:Chemotherapy.1984;32(S-7):39-61
41
Tanaka, M.,et al.:J. Infect. Chemother.2002:8(1):81-86
42
横田 健,et al.:Chemotherapy.1984;32(S-7):16-21