1
厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
2
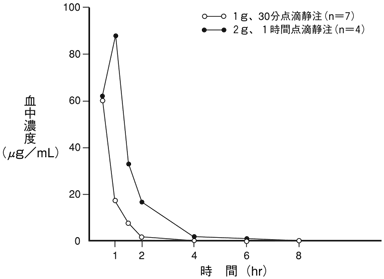
松田静治ほか:Chemotherapy.1977;25(5):1429-1437
3
K. Yamamoto, et al.:Annals Pharmacotherapy.1997;31(10):1261-1262
4
柴孝也:日本化学療法学会雑誌.2003;51(2):76-86
5
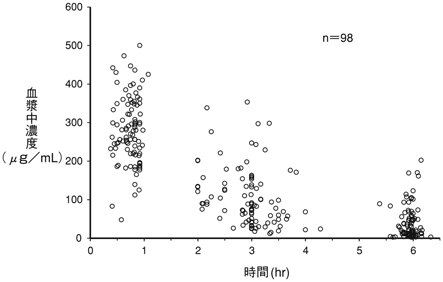
松本慶蔵ほか:Chemotherapy.1994;42(S-2):281-299
6
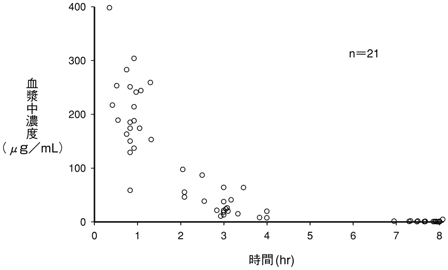
木藤光彦ほか:Jpn. J. Antibiot.1983;36(8):2077-2080
7
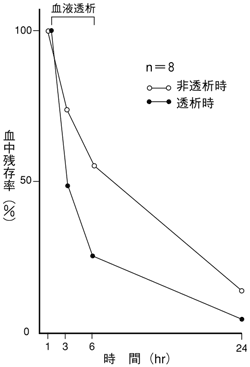
高瀬善次郎ほか:産婦人科の世界.1982;34(12):1353-1367
8
宍戸春美ほか:Chemotherapy.1977;25(5):1141-1155
9
松本慶蔵ほか:Chemotherapy.1977;25(5):1105-1121
10
伊藤秀夫ほか:Chemotherapy.1977;25(5):1549-1552
11
才川勇ほか:Chemotherapy.1977;25(5):810-815
12
Y. Minami, et al.:J. Antibiot.1991;44(2):256-258
13
Morrison J. A., et al.:Drugs Exptl. Clin. Res.1981;7(4):415-419
14
草場亮輔ほか:薬理と治療.1982;10(7):4053-4057
15
中川圭一ほか:Chemotherapy.1978;26(2):123-166
16
河田幸道ほか:泌尿紀要.1977;23(7):713-742
17
植尾健次ほか:Chemotherapy.1977;25(5):700-709
18
松崎薫ほか:Jpn. J. Antibiot.2000;53(8):573-581