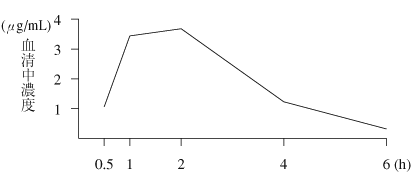
1
厚生労働省健康局結核感染症課編: 抗微生物薬適正使用の手引き[R-07700]
2
松本文夫: 第21回日本化学療法学会総会シンポジウム Amoxycillin, 1973[SAW-05134]
3
古谷 博 他: 日本化学療法学会雑誌 1973; 21(8): 1752-1758[SAW-00180]
4
青河寛次 他: 日本化学療法学会雑誌 1973; 21(8): 1780-1786[SAW-00184]
5
村川武雄 他: 日本化学療法学会雑誌 1973; 21(8): 1399-1408[SAW-00115]
6
古沢悌二 他: 日本化学療法学会雑誌 1973; 21(8): 1624-1628[SAW-00161]
7
楠 信男 他: 日本化学療法学会雑誌 1978; 26(3): 311-316[SAW-00744]
8
日本化学療法学会雑誌 1973; 21(8)を中心に集計
9
三橋 進 他: 日本化学療法学会雑誌 1973; 21(8): 1355-1358[SAW-00113]
10
小酒井望 他: 日本化学療法学会雑誌 1973; 21(8): 1359-1368[SAW-00133]
11
中沢昭三 他: 日本化学療法学会雑誌 1973; 21(8): 1375-1382[SAW-00135]
12
山口恵三 他: 日本化学療法学会雑誌 1989; 37(S-2): 97-99[SAW-02506]