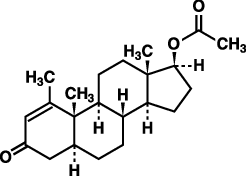
1
Johnson FL, et al.: Lancet. 1972; 2: 1273-1276
2
Oda K, et al.: Acta Haematol Jpn. 1987; 50: 29-36
3
Haupt HA, et al.: Am J Sports Med. 1984; 12: 469-484
4
Gerhards E, et al.: Hoppe Seyler's Z Physiol Chem. 1965; 342: 40-62
5
Nowakowski H, et al.: Med Klin. 1966; 61: 223-227
6
Fiegel G: Arzneim-Forsch. 1964; 14: 1218-1221