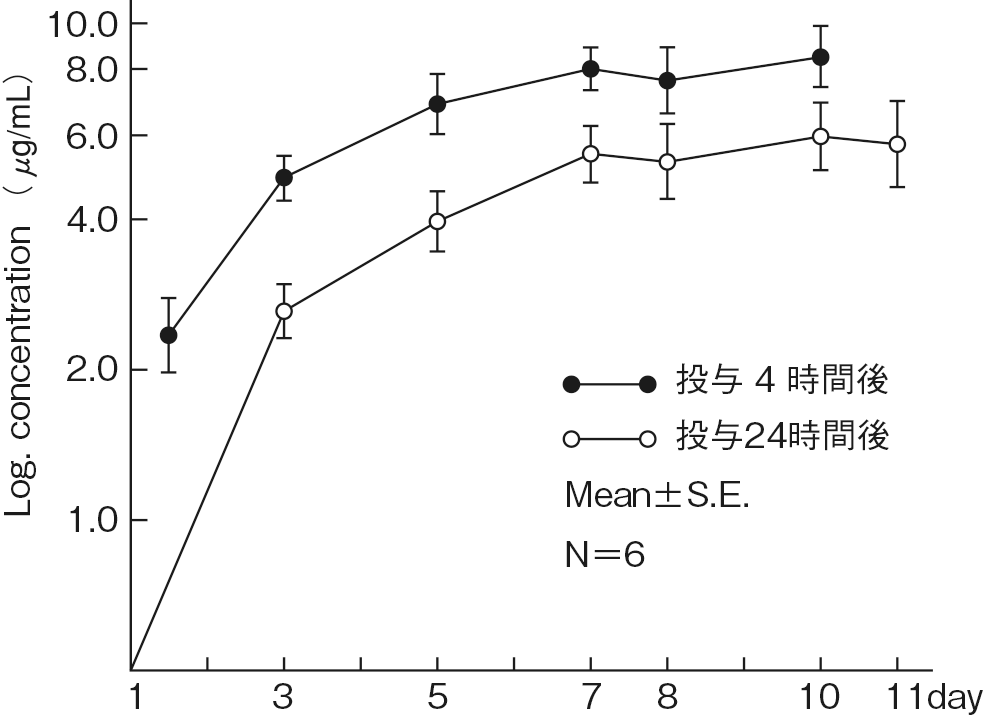
1
酒井 健夫ほか:薬理と治療.1980;8(12):4655-4671
2
門間 和夫ほか:日本新生児学会雑誌.1984;20(3):508-518
3
Ostensen, M.:Eur. J. Clin. Pharmacol. 1983;25:829-830
4
Ostensen, M., et al.:Eur. J. Clin. Pharmacol. 1988;35:567-569
5
Jacotot, B.:Proceedings of 9th European Congress of Rheumatology.1979:46-47
6
宮川 朋大ほか:精神医学.1996;38(2):205-207
7
Baker, D. E.:Drug Intell. Clin. Pharm. 1988;22:505-506
8
Ferry, D. G., et al.:Eur. J. Clin. Pharmacol. 1990;39, 599-601
9
厚生省薬務局:医薬品研究.1994;25(11):1026-1034
10
Mendonça, L. L. F., et al.:Rheumatology.2000;39:880-882
11
Akil, M., et al.:Br. J. Rheumatol. 1996;35(1):76-78
12
Smith, G., et al.:Br. J. Rheumatol. 1996;35(5):458-462
13
Calmels, C., et al.:Rev. Rhum.(Engl. Ed.)1999;66(3):167-168
14
七川 歓次ほか:リウマチ.1980;20(3):214-219
15
菅原 幸子ほか:薬理と治療.1981;9(2):507-517
16
七川 歓次ほか:リウマチ.1980;20(3):220-228
17
景山 孝正ほか:臨床成人病.1981;11(6):927-940
18
青木 虎吉ほか:臨床成人病.1981;11(7):1101-1111
19
景山 孝正ほか:臨床薬理.1981;12(3):277-296
20
Carty, T. J., et al.:Prostaglandins.1980;19(5):671-682
21
大槻 勲夫ほか:薬理と治療.1980;8(12):4623-4638
22
Wiseman, E. H., et al.:Arzneim. Forsch. 1976;26(7):1300-1303
23
Abramson, S., et al.:Semin. Arthritis Rheum. 1983;13(1, Suppl. 1):148-153