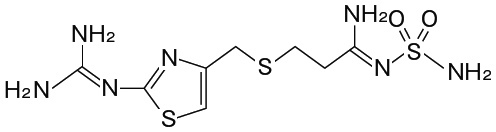
1
猪爪信夫 他:Prog. Med. 1996;16(11):2897-2903[GA-3287]
2
二木芳人:Today's Therapy 1994;18(2):42-45[GA-2621]
3
Lim, S.G. et al.:Aliment. Pharmacol. Ther. 1993;7:317-321[GA-2622]
4
末永高寛 他:薬理と臨床 1998;8(6):637-647[GA-05119]
5
今井康彦 他:薬理と治療 1996;24(3):615-620[GA-2908]
6
社内報告書:ヒト・薬物動態(D199602641-01.00, 1987)
7
社内報告書:ヒト・薬物動態(D199502069-01.00, 1986)
8
牧山和也 他:臨床と研究 1984;61(5):1660-1666[GA-0417]
9
細田四郎 他:新薬と臨床 1983;32(10):1579-1586[GA-0465]
10
湯川永洋 他:新薬と臨床 1983;32(12):1926-1933[GA-0439]
11
城所 仂 他:薬理と治療 1983;11(9):3659-3674[GA-0462]
12
関口利和 他:診療と新薬 1983;20(11):2476-2485[GA-0449]
13
白鳥敬子 他:日本消化器病学会雑誌 1984;81(7):1623-1627[GA-0408]
14
三好秋馬 他:内科宝函 1987;34(11):391-403[SJA-00794]
15
三好秋馬 他:内科宝函 1987;34(11):405-417[SJA-00848]
16
関口利和 他:医学と薬学 1987;18(1):172-182[GA-0234]
17
金子栄蔵 他:基礎と臨床 1995;29(3):747-763[GA-2362]
18
加藤則廣 他:薬理と治療 1995;23(2):419-431[GA-2363]
19
三好秋馬 他:薬理と治療 1988;16(1):119-140[GA-0154]
20
三好秋馬 他:医学と薬学 1988;19(1):147-163[GA-0170]
21
浅木 茂 他:臨床と研究 1995;72(2):513-524[GA-2342]
22
下山 孝 他:薬理と治療 1995;23(2):407-418[GA-2361]
23
関口利和 他:新薬と臨床 1995;44(2):135-146[GA-2364]
24
三輪 剛 他:臨床と研究 1995;72(3):716-724[GA-2365]
25
大江慶治 他:内科宝函 1983;30(11):365-378[GA-0440]
26
大江慶治 他:内科宝函 1984;31(1):11-24[GA-0423]
27
渡部洋三 他:薬理と治療 1983;11(9):3637-3650[GA-0464]
28
社内報告書:ヒト・薬理作用(DIR180097)
29
三好秋馬 他:基礎と臨床 1983;17(9):2909-2916[GA-0468]
30
三好秋馬 他:基礎と臨床 1983;17(9):2917-2927[GA-0470]
31
大江慶治 他:内科宝函 1984;31(2):51-62[GA-0411]
32
池添逸夫 他:日本消化器病学会雑誌 1983;80(Suppl.):694[GA-0418]
33
Miwa, M. et al.:Int. J. Clin. Pharmacol. Ther. Toxicol.1984;22(4):214-217[GA-0751]
34
宮本二郎 他:薬理と治療 1983;11(9):3651-3658[GA-0463]
35
森 治樹 他:日本臨床 1984;42(1):150-157[JP-P00730]
36
原沢 茂 他:診療と新薬 1983;20(9):1859-1864[GA-0459]
37
大西久仁彦 他:薬理と治療 1983;11(10):4301-4304[GA-1463]
38
三好秋馬 他:新薬と臨床 1983;32(9):1383-1395[GA-0477]
39
早川 滉 他:臨床成人病 1984;14(4):571-577[GA-0422]
40
竹田正明 他:基礎と臨床 1983;17(9):2878-2882[GA-0472]
41
Takeda, M. et al.:Eur. J. Pharmacol. 1983;91(4):371-376[GA-0756]
42
Takagi, T. et al.:Arch. Int. Pharmacodyn. Ther. 1982;256(1):49-58[GA-0760]
43
竹田正明 他:基礎と臨床 1984;18(12):6125-6134[GA-0384]
44
Takeda, M. et al.:Arzneimittel-Forschung 1982;32(7):734-737[GA-0759]
45
岡部 進 他:応用薬理 1984;27(3):563-569[GA-0416]
46
Ishihara, Y. et al.:Digestion 1983;27(1):29-35[GA-0757]
47
宮田桂司 他:基礎と臨床 1987;21(16):6063-6073[SJA-00628]