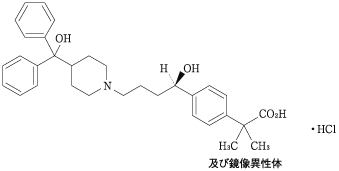
1
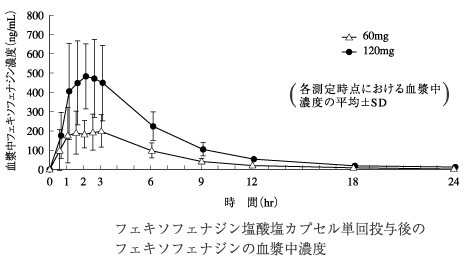
社内資料:健康成人における薬物動態(2000年9月22日承認、申請資料概要ヘ.III.1.(1))
2
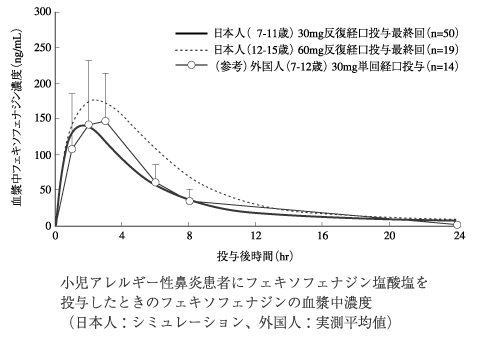
社内資料:小児における薬物動態(2006年10月20日承認、CTD2.5.3(2))
3
社内資料:食事の影響(2000年9月22日承認、申請資料概要ヘ.III.1.(1).2))
4
社内資料:健康成人における蛋白結合
5
社内資料:健康成人における代謝(2000年9月22日承認、申請資料概要ヘ.III.1.(2))
6
社内資料:腎機能障害患者における薬物動態(2000年9月22日承認、申請資料概要ヘ.III.3.(4))
7
社内資料:肝機能障害患者における薬物動態(2000年9月22日承認、申請資料概要ヘ.III.3.(3))
8
社内資料:高齢者における薬物動態(2000年9月22日承認、申請資料概要ヘ.III.3.(2))
9
浦江明憲 他:臨床薬理. 2000;31(5):639-48
10
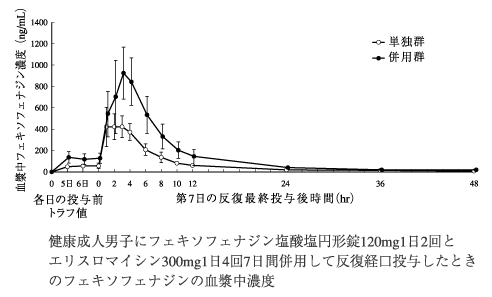
社内資料:エリスロマイシンとの相互作用(2000年9月22日承認、申請資料概要ヘ.III.2.(1)、ト.I.5.(1))
11
社内資料:オメプラゾール及び水酸化アルミニウムゲル・水酸化マグネシウムとの相互作用(2000年9月22日承認、申請資料概要ヘ.III.2.(3)(4))
12
社内資料:ケトコナゾールとの相互作用(2000年9月22日承認、申請資料概要ヘ.III.2.(2))
13
Kawashima M, et al.:Int Arch Allergy Immunol. 2001;124(1-3):343-5
14
Finn A F, et al. :J Allergy Clin Immunol. 1999;104(5):1071-8
15
社内資料:季節性アレルギー鼻炎患者における用量比較試験(2000年9月22日承認、申請資料概要ト.II.2.(2))
16
Bernstein D I, et al.:Ann Allergy Asthma Immunol. 1997;79(5):443-8
17
馬場廣太郎:耳鼻咽喉科臨床. 2007;100(2)補冊(119):1-20
18
Kawashima M, et al.:Br J Dermatol. 2003;148(6):1212-21
19
中川秀己 他:西日本皮膚科. 2006;68(5):553-65
20
浦江明憲 他:臨床薬理. 2000;31(5):649-58
21
Tashiro M, et al.:J Clin Pharmacol. 2004;44(8):890-900
22
Weiler J M, et al.:Ann Intern Med. 2000;132:354-63
23
Pratt C M, et al.:Am J Cardiol. 1999;83:1451-4
24
Pratt C, et al.:Clin Exp Allergy. 1999;29(Suppl.3):212-6
25
社内資料:高用量における心電図の検討試験(2000年9月22日承認、申請資料概要ト.I.5.(4))
26
社内資料:QTc間隔延長の可能性に関する検討(2000年9月22日承認、申請資料概要ホ.II.2.(1))
27
社内資料:薬効薬理の検討
28
Abdelaziz M M, et al.:J Allergy Clin Immunol. 1998;101:410-20