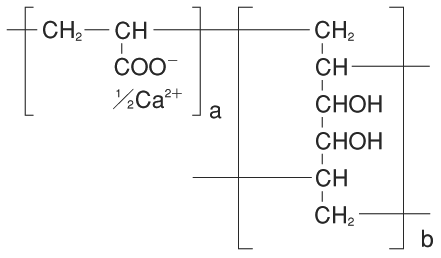
1
山田健久 他:医薬品研究 1997;28(1):23-32[COL-00003]
2
山田健久 他:医薬品研究 1997;28(1):33-39[COL-00004]
3
正宗 研 他:薬理と治療 1998;26(S-5):S945-S965[COL-00007]
4
正宗 研 他:薬理と治療 1998;26(S-5):S967-S996[COL-00008]
5
Yamada, T. et al.:Pharm. Sci. 1996;2:149-152[COL-00173]
6
Yasumori, A. et al.:Jpn. J. Pharmacol. 1998;76(Suppl.1):296[COL-00027]
7
Saito, T. et al.:Jpn. J. Pharmacol. 2000;83(3):206-214[COL-00028]
8
Saito, T. et al.:Jpn. J. Pharmacol. 2002;89(2):133-141[COL-00174]







 254
254