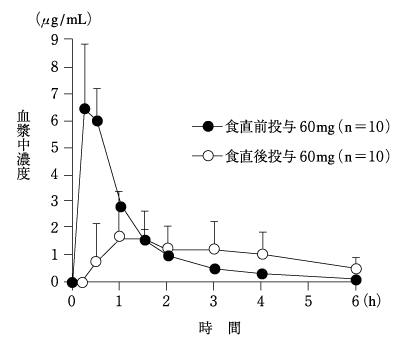
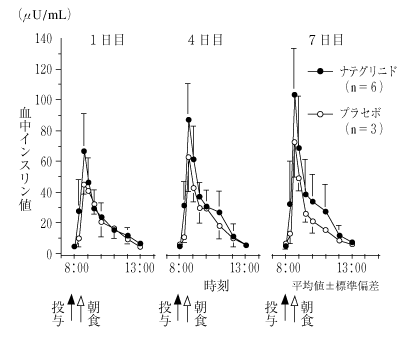
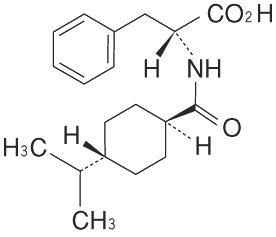
1
小坂樹徳 他:薬理と臨床 1997;7(5):585-599[ST-00024]
2
小坂樹徳 他:薬理と臨床 1997;7(5):615-634[ST-00022]
3
菊池方利 他:臨床医薬 2008;24(8):717-739[ST-01319]
4
小坂樹徳 他:薬理と臨床 1997;7(5):653-668[ST-00020]
5
Hirschberg, Y. et al.:Diabetes Care 2000;23(3):349-353[ST-00161]
6
江藤 隆 他:臨床医薬 2009;25(1):77-91[ST-01343]
7
小坂樹徳 他:薬理と臨床 1997;7(5):699-727[ST-00018]
8
小坂樹徳 他:薬理と臨床 1997;7(5):797-818[ST-00017]
9
葛谷 健 他:薬理と臨床 1997;7(5):819-832[ST-00016]
10
垂井清一郎 他:薬理と臨床 1997;7(5):767-784[ST-00025]
11
EAファーマ(株)社内資料:2型糖尿病患者・第Ⅱ相二重盲検群間比較試験-補足資料(DIR080168)
12
菊池方利:臨床医薬 2008;24(8):741-760[ST-01320]
13
菊池方利 他:臨床医薬 2009;25(1):35-56[ST-01341]
14
社内報告書:2型糖尿病患者・第Ⅱ/Ⅲ相二重盲検群間比較試験-補足資料(DIR090097)
15
菊池方利:臨床医薬 2009;25(1):57-75[ST-01342]
16
Ikenoue, T. et al.:Br. J. Pharmacol. 1997;120(1):137-145[ST-00096]
17
小坂樹徳 他:薬理と臨床 1997;7(5):601-614[ST-00023]
18
EAファーマ(株)社内資料:自然発症糖尿病モデルGKラット・薬理作用(DIR070095)
19
秋吉 恵 他:基礎と臨床 1997;31(5):1725-1735[ST-00002]
20
Ikenoue, T. et al.:Biol. Pharm. Bull. 1997;20(4):354-359[EG-853]