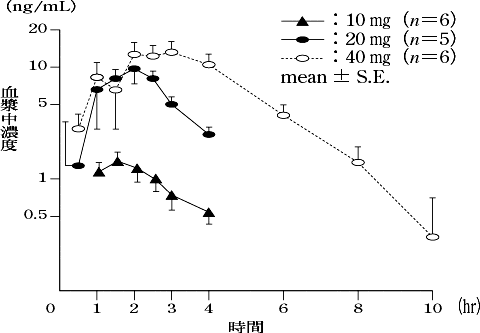
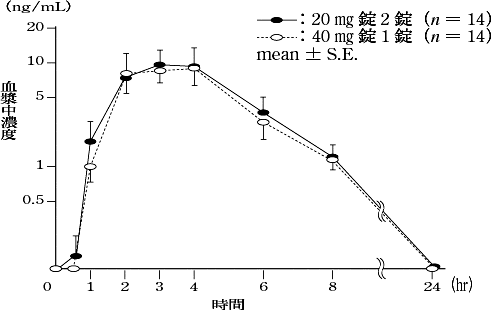
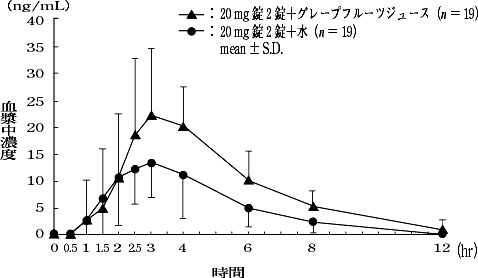
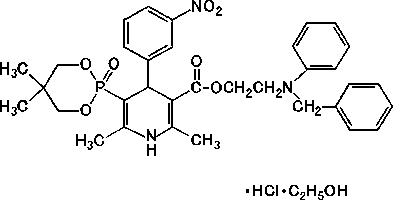
1
中島光好 他:臨床薬理. 1991; 22(3): 673-683
2
社内資料:NZ-105のLC/MSでの定量法
3
社内資料:ヒトにおけるカルシウム拮抗剤NZ-105(20mg錠及び40mg錠)の生物学的同等性の検討
4
篠崎 豊 他:薬物動態. 1991; 6(6): 945-953
5
横山正一 他:日腎誌. 1992; 34(2): 199-205
6
矢島洋一 他:薬理と治療. 2003; 31(7): 579-588
7
村松 準 他:Ther. Res. 1991; 12(12): 4129-4139
8
漆山和夫 他:薬理と臨床. 1991; 1(6): 339-345
9
塩見利明 他:診療と新薬. 1991; 28(11): 2062-2070
10
吉永 馨 他:薬理と臨床. 1991; 1(6): 347-356
11
山田和生 他:医学のあゆみ. 1992; 161(4): 275-292
12
大内尉義 他:Geriat. Med. 1992; 30(1): 109-120
13
赤塚宣治 他:基礎と臨床. 1996; 30(12): 3517-3531
14
西山敬介 他:基礎と臨床. 1996; 30(12): 3501-3516
15
篠山重威 他:基礎と臨床. 1996; 30(12): 3483-3499
16
山田和生 他:基礎と臨床. 1996; 30(12): 3295-3315
17
山田和生 他:基礎と臨床. 1996; 30(12): 3403-3432
18
山田和生 他:基礎と臨床. 1996; 30(12): 3433-3464
19
谷口興一 他:基礎と臨床. 1996; 30(12): 3283-3294
20
堀 正二 他:基礎と臨床. 1996; 30(12): 3375-3387
21
山田和生 他:基礎と臨床. 1996; 30(12): 3337-3354
22
Tamura,T.et al.:Naunyn-Schmiedeberg's Arch. Pharmacol. 1991; 343: 405-410
23
Yamashita,T.et al.:Jpn. J. Pharmacol. 1991; 57: 337-348
24
Masuda,Y.et al.:Arch. Int. Pharmacodyn. Ther. 1990; 304: 247-264
25
坂井俊則 他:応用薬理. 1991; 42(1): 55-60
26
坂井俊則 他:応用薬理. 1991; 42(1): 43-54
27
村松 準 他:Ther. Res. 1991; 12(12): 4119-4127
28
谷口興一 他:臨床と研究. 1991; 68(10): 3135-3144
29
佐藤隆一 他:応用薬理. 1997; 53(2): 101-108