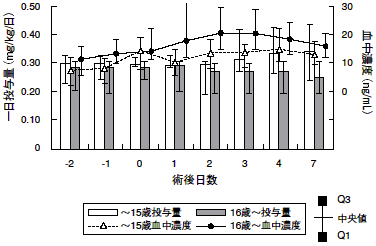
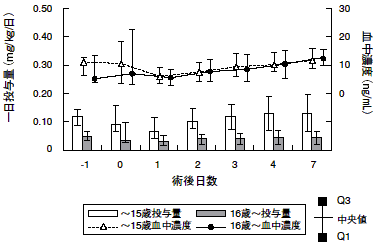
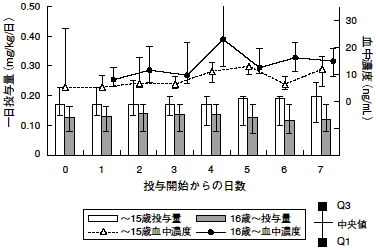
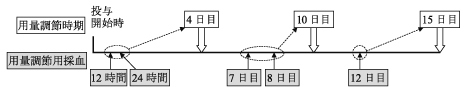
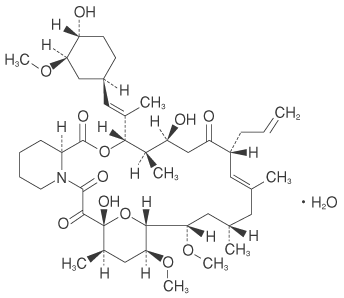
1
Saegusa, T. et al.:基礎と臨床 1992;26(3):969-981[PRG-01148]
2
Zheng, S. et al.:Br. J. Clin. Pharmacol. 2013;76(6):988-996[PRG-36798]
3
Coscia, L.A. et al.:Best Pract. Res. Clin. Obstet. Gynaecol. 2014;28(8):1174-1187[PRG-36799]
4
Jain, A. et al.:Transplantation 1997;64(4):559-565[PRG-05533]
5
Fung, J. J. et al.:Transplant. Proc. 1990;22(1)Suppl.1:6-12[PRG-00191]
6
Curran, C. F. et al.:Transplantation 1996;62(9):1376-1377[PRG-04546]
7
Mrvos, R. et al.:J. Toxicol. Clin. Toxicol. 1997;35(4):395-399[PRG-05400]
8
社内報告書:ラット・生殖毒性(DIR940072)
9
石橋道男 他:移植 1994;29(3):294-313[PRG-02352]
10
社内報告書:小児腎移植患者・薬物動態(DIR080173)
11
社内報告書:腎移植患者・薬物動態(DIR080174)
12
McDiarmid, S. V. et al.:Transplantation 1993;55(6):1328-1332[PRG-01716]
13
社内報告書:肝移植患者・薬物動態(DIR080175)
14
Jain, A. et al.:Transplant. Proc. 1994;26(3):1609-1610[PRG-02370]
15
社内報告書:骨髄移植患者・薬物動態(DIR080176)
16
社内報告書:重症筋無力症患者・薬物動態(DIR090173)
17
社内報告書:重症筋無力症患者・薬物動態(DIR160018)
18
社内報告書:関節リウマチ患者・薬物動態(2005年4月11日承認 申請資料概要ヘ-1-2)-(1))(DIR050001)
19
社内報告書:関節リウマチ患者・薬物動態(2005年4月11日承認 申請資料概要ヘ-1-2)-(2))(DIR050002)
20
社内報告書:関節リウマチ患者・薬物動態(2005年4月11日承認 申請資料概要ヘ-1-2)-(3))(DIR050003)
21
社内報告書:ループス腎炎患者・薬物動態(2007年1月26日承認 CTD 2.7.2)(DIR070003)
22
社内報告書:潰瘍性大腸炎患者・薬物動態(DIR090108)
23
社内報告書:多発性筋炎・皮膚筋炎に合併する間質性肺炎患者・医師主導治験・薬物動態(DIR130021)
24
高原史郎 他:今日の移植 1999;12(5):537-543[PRG-08414]
25
Dressler, D. et al.:Clin. Pharmacol. Ther. 1996;59(2):151[PRG-03974]
26
社内報告書:潰瘍性大腸炎患者・薬物動態(2009年7月7日承認 CTD 2.7.2.3.3)(DIR090109)
27
Iwasaki, K. et al.:薬物動態 1998;13(3):259-265[PRG-06905]
28
Christians, U. et al.:Transplant. Proc. 1991;23(6):2741-2744[PRG-00688]
29
Venkataramanan, R. et al.:Transplant. Proc. 1991;23(6):2736-2740[PRG-00687]
30
深尾 立 他:移植 1994;29(6):614-631[PRG-02754]
31
落合武徳 他:移植 1994;29(6):650-681[PRG-02756]
32
高橋公太 他:移植 1994;29(6):682-697[PRG-02757]
33
大島伸一 他:移植 2001;36(1):20-38[PRG-10222]
34
社内報告書:腎移植患者・第Ⅲ相試験(移植前投与期間延長)(DIR230029)
35
上本伸二 他:臨床麻酔 1993;17(8):1087-1089[PRG-01833]
36
Inomata, Y. et al.:Transplantation 1996;61(2):247-252[PRG-03643]
37
上本伸二 他:今日の移植 1999;12(4):445-451[PRG-08155]
38
上本伸二 他:今日の移植 2000;13(2):185-194[PRG-08973]
39
Reichart, B. et al.:J. Heart Lung Transplant. 1998;17(8):775-781[PRG-07233]
40
Taylor, D. O. et al.:J. Heart Lung Transplant. 1999;18(4):336-345[PRG-07960]
41
Mentzer, R. M. Jr. et al.:Transplantation 1998;65(1):109-113[PRG-06237]
42
Pham, S. M. et al.:J. Thorac. Cardiovasc. Surg. 1996;111(4):764-772[PRG-03803]
43
Keenan, R. J. et al.:Ann. Thorac. Surg. 1995;60(3):580-585[PRG-03344]
44
Reichenspurner, H. et al.:Transplantation 1999;68(1):67-71[PRG-08173]
45
Gruessner, R. W. G.:Clin. Transplant. 1997;11(4):299-312[PRG-05540]
46
Corry, R. J. et al.:Transplant. Proc. 1998;30(2):521[PRG-06437]
47
Atkison, P. et al.:Pediatr. Transplant. 1997;1(2):111-118[PRG-08067]
48
古川博之 他:今日の移植 1997;10(4):527-536[PRG-05378]
49
Kareem, M. A. et al.:Ann. Surg. 2009;250(4):567-581[PRG-25785]
50
平岡 諦 他:今日の移植 1997;10(4):593-604[PRG-05380]
51
金丸昭久 他:今日の移植 1998;11(3):367-380[PRG-06465]
52
平岡 諦 他:今日の移植 1998;11(5):649-676[PRG-07196]
53
平岡 諦 他:今日の移植 2000;13(3):277-288[PRG-09279]
54
正岡 徹 他:今日の移植 1993;6(3):313-320[PRG-01707]
55
社内報告書:全身型重症筋無力症患者・前期第Ⅱ相試験(DIR090168)
56
社内報告書:重症筋無力症患者・第Ⅲ相比較試験(2009年10月16日承認 CTD 2.7.6.1)(DIR090170)
57
社内報告書:重症筋無力症患者・第Ⅲ相非盲検試験(2009年10月16日承認 CTD 2.7.6.2)(DIR090171)
58
Kondo, H. et al.:J. Rheumatol. 2004;31(2):243-251[PRG-15720]
59
社内報告書:関節リウマチ患者・後期第Ⅱ相高齢者試験(2005年4月11日承認 申請資料概要ト-1-4))(DIR050004)
60
社内報告書:関節リウマチ患者・第Ⅲ相比較試験(2005年4月11日承認 申請資料概要ト-1-5))(DIR050005)
61
Kawai, S. et al.:Rheumatology 2006;45(4):441-444[PRG-19478]
62
社内報告書:ループス腎炎患者・第Ⅲ相比較試験(2007年1月26日承認 CTD 2.7.6.1、CTD 2.7.3.3)(DIR070004)
63
社内報告書:潰瘍性大腸炎患者・第Ⅲ相比較試験(2009年7月7日承認 CTD 2.7.6.1)(DIR090105)
64
社内報告書:潰瘍性大腸炎患者・第Ⅲ相非盲検試験(2009年7月7日承認 CTD 2.7.6.2)(DIR090106)
65
社内報告書:多発性筋炎・皮膚筋炎に合併する間質性肺炎患者・医師主導治験(2013年6月14日承認 CTD 2.7.6.1)(DIR130022)
66
社内報告書:腎移植患者・使用成績調査等(DIR080178)
67
社内報告書:肝移植患者・使用成績調査(DIR080177)
68
社内報告書:心移植患者・使用成績調査等(DIR120159)
69
社内報告書:肺移植患者・特定使用成績調査(DIR120160)
70
社内報告書:膵移植患者・特定使用成績調査(DIR120161)
71
社内報告書:骨髄移植患者・使用成績調査等(DIR080179)
72
奥原正國 他:日本農芸化学会誌 1996;70(1):1-8 [PRG-03740]
73
Kino, T. et al.:J. Antibiot. 1987;40(9):1256-1265[PRG-00003]
74
Sakuma, S. et al.:Br. J. Pharmacol. 2000;130(7):1655-1663[PRG-09368]
75
Sakuma, S. et al.:Int. Immunopharmacol. 2001;1(4):749-757[PRG-10660]
76
Monden, M. et al.:Transplant. Proc. 1990;22(1)Suppl.1:66-71[PRG-00207]
77
Todo, S. et al.:Transplant. Proc. 1987;19(5)Suppl.6:64-67[PRG-00039]
78
稲垣和郎:広島大学医学雑誌 1988;36(1):81-89[PRG-00110]
79
岡村直孝:移植 1991;26(5):436-444[PRG-00678]
80
Mazzaferro, V. et al.:Transplant. Proc. 1990;22(1)Suppl.1:93-95[PRG-00216]
81
Loreal, O. et al.:Transplant. Proc. 1991;23(6):2825-2828[PRG-00715]
82
社内報告書:マウス移植片対宿主病モデル・薬理作用(DIR940004)
83
Markus, P. M. et al.:Surgery 1991;110(2):357-364[PRG-00582]
84
Todo, S. et al.:Surgery 1989;106(2):444-451[PRG-00091]
85
Ochiai, T. et al.:Transplant. Proc. 1987;19(5)Suppl.6:53-56[PRG-00035]
86
社内報告書:ラット腎移植モデル・薬理作用(DIR960009)
87
Ochiai, T. et al.:Transplantation 1987;44(6):734-738[PRG-00050]
88
和田洋巳 他:今日の移植 1992;5(4):387-391[PRG-01270]
89
剣持 敬 他:日本外科学会雑誌 1992;93(6):626-631[PRG-01169]
90
Sakuma, S. et al.:Inflamm. Res. 2001;50(10):509-514[PRG-11482]
91
Magari, K. et al.:Inflamm. Res. 2003;52(12):524-529[PRG-15696]
92
Magari, K. et al.:J. Rheumatol. 2003;30(10):2193-2200[PRG-15312]
93
社内報告書:マウス腎炎モデル・薬理作用(DIR060209)
94
社内報告書:マウス腎炎モデル・薬理作用(DIR060210)
95
社内報告書:IL10欠損マウス・薬理作用(DIR090125)
96
社内報告書:IL10欠損マウス・薬理作用(DIR090123)
97
Fujiki, M. et al.:Am. J. Respir. Cell Mol. Biol. 1999;21(6):675-683[PRG-08654]
98
Koshika, T. et al.:Am. J. Respir. Crit. Care Med. 2001;163(1):79-84[PRG-10109]
99
Koshika, T. et al.:Eur. J. Pharmacol. 2005;515(1-3):169-178[PRG-18045]
100
Yoshikawa, H. et al.:J. Autoimmun. 1997;10(1):11-16[PRG-04959]




 607
607
 617
617