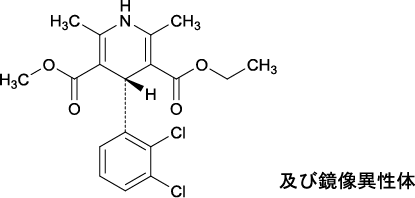
1
中島光好, 他. 臨床医薬. 1992;8(8):1763-1780
2
中島光好, 他. 臨床医薬. 1992;8(8):1781-1795
3
Edgar B, et al. Clin Pharmacol Ther. 1985 Aug;38(2):205-211
4
Uno K, et al. 薬物動態. 1991;6(5):769-779
5
Regardh CG, et al. Eur J Clin Pharmacol. 1989;36(5):473-479
6
Janzon K, et al. Acta Pharmacol Toxicol. 1986;59(Suppl.V):98
7
Rehnqvist N, et al. Drugs. 1987;34(Suppl.3):33-42
8
Smith SR, et al. Eur J Clin Pharmacol. 1987;31(5):575-578
9
荒川規矩男, 他. 臨床医薬. 1992;8(11):2659-2691
10
井上 勉, 他. 日薬理誌. 1992;100:453-462
11
荒川規矩男, 他. 臨床医薬. 1992;8(Suppl.6):3-22
12
Verdouw PD, et al. Naunyn Schmiedebergs Arch Pharmacol. 1983 Aug;323(4):350-354
13
松本高宏, 他. 臨床と研究. 1992;69(4):1265-1269
14
Kuroda K, et al. Arzneimittelforschung. 1991 Jul;41(7): 709-714
15
Nyborg NCB, et al. J Cardiovasc Pharmacol. 1984 May-Jun;6(3):499-505
16
Ljung B, Drugs. 1985;29(Suppl.2):46-58
17
Nordlander M, et al. Eur J Pharmacol. 1985;113(1):25-36
18
Tanaka M, et al. Jpn J Pharmacol. 1990;52:273-279
19
山本 滋, 他. 薬理と治療. 1992;20(2):419-457