1
イカチバントの非臨床毒性試験成績①(2018年9月21日承認、CTD 2.6.6.6)
2
イカチバントの非臨床薬物動態試験成績①(2018年9月21日承認、CTD 2.6.4.6)
3
イカチバントの非臨床毒性試験成績②(2018年9月21日承認、CTD 2.6.6.3)
4
イカチバントの海外第Ⅰ相試験成績①(2018年9月21日承認、CTD 2.7.6.11)
5
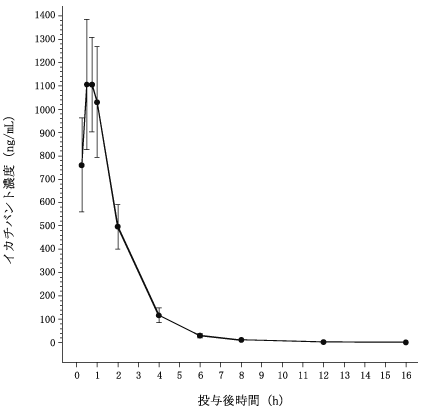
イカチバントの薬物動態試験成績(2022年8月24日承認、CTD 2.7.2.3)
6
イカチバントの海外第Ⅰ相試験成績②(2018年9月21日承認、CTD 2.7.6.10)
7
イカチバントの海外第Ⅰ相試験成績③(2018年9月21日承認、CTD 2.7.6.1)
8
イカチバントの非臨床薬物動態試験成績②(2018年9月21日承認、CTD 2.6.4.4)
9
イカチバントの非臨床薬物動態試験成績③(2018年9月21日承認、CTD 2.6.4.5)
10
イカチバントの海外第Ⅰ相試験成績④(2018年9月21日承認、CTD 2.7.6.2)
11
イカチバントの海外第Ⅰ相試験成績⑤(2018年9月21日承認、CTD 2.7.6.3)
12
イカチバントの海外第Ⅱa相試験成績(2018年9月21日承認、CTD 2.7.6.8)
13
イカチバントの臨床薬理試験成績(2018年9月21日承認、CTD 2.7.2.2)
14
イカチバントの非臨床薬物動態試験成績④(2018年9月21日承認、CTD 2.6.4.7)
15
William R. Lumry, et al.:Ann Allergy Asthma Immunol. 2011;Vol.107:529-537.
16
イカチバントの海外第Ⅲ相試験成績①(2018年9月21日承認、CTD 2.7.6.16)
17
秀道広, 他:アレルギー. 2018;67(2):139-147.
18
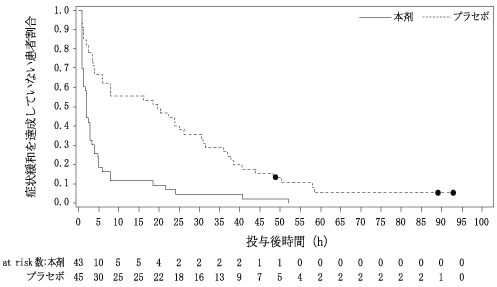
イカチバントの国内第Ⅲ相試験成績①(2018年9月21日承認、CTD 2.7.6.20)
19
イカチバントの海外第Ⅲ相試験成績②(2022年8月24日承認、CTD 2.7.6.3)
20
イカチバントの国内第Ⅲ相試験成績②(2022年8月24日承認、CTD 2.7.6.2)
21
イカチバントの非臨床薬理試験成績(2018年9月21日承認、CTD 2.6.2.2)
22
E.D. Han Lee, et al.:Immunology Letters. 2003;Vol.89:155–160.
23
イカチバントの海外第Ⅰ相試験成績⑥(2018年9月21日承認、CTD 2.7.6.5)