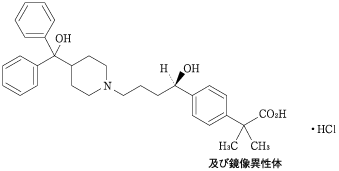
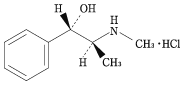
1
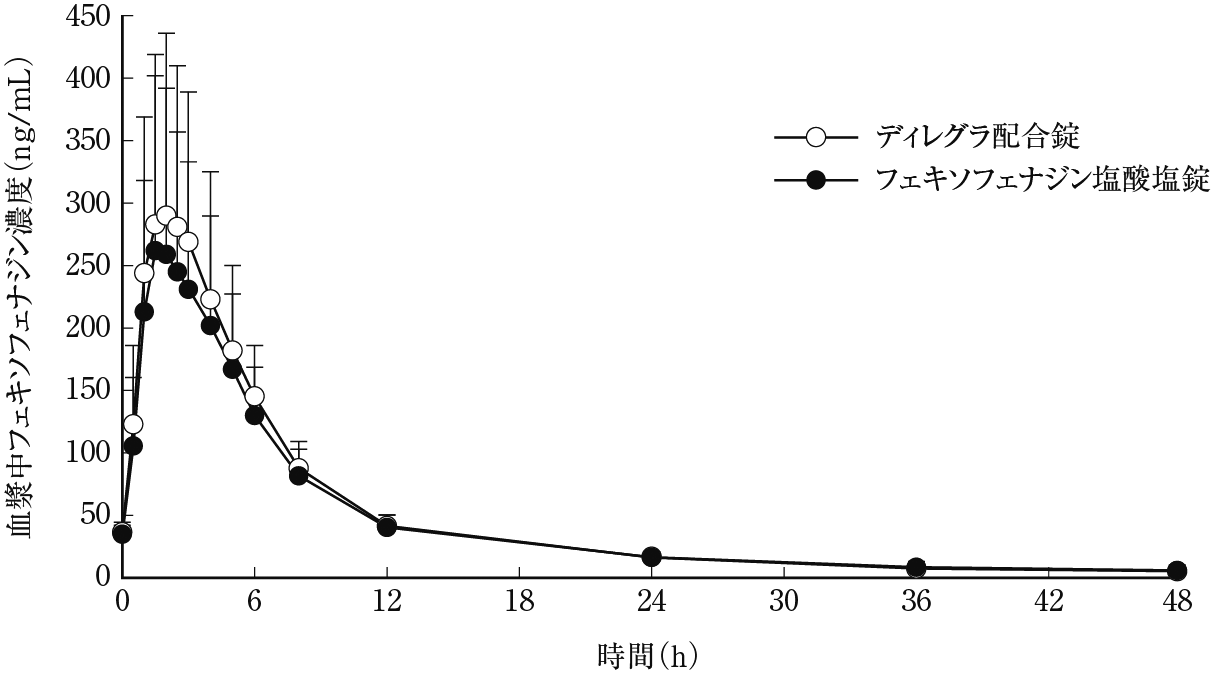
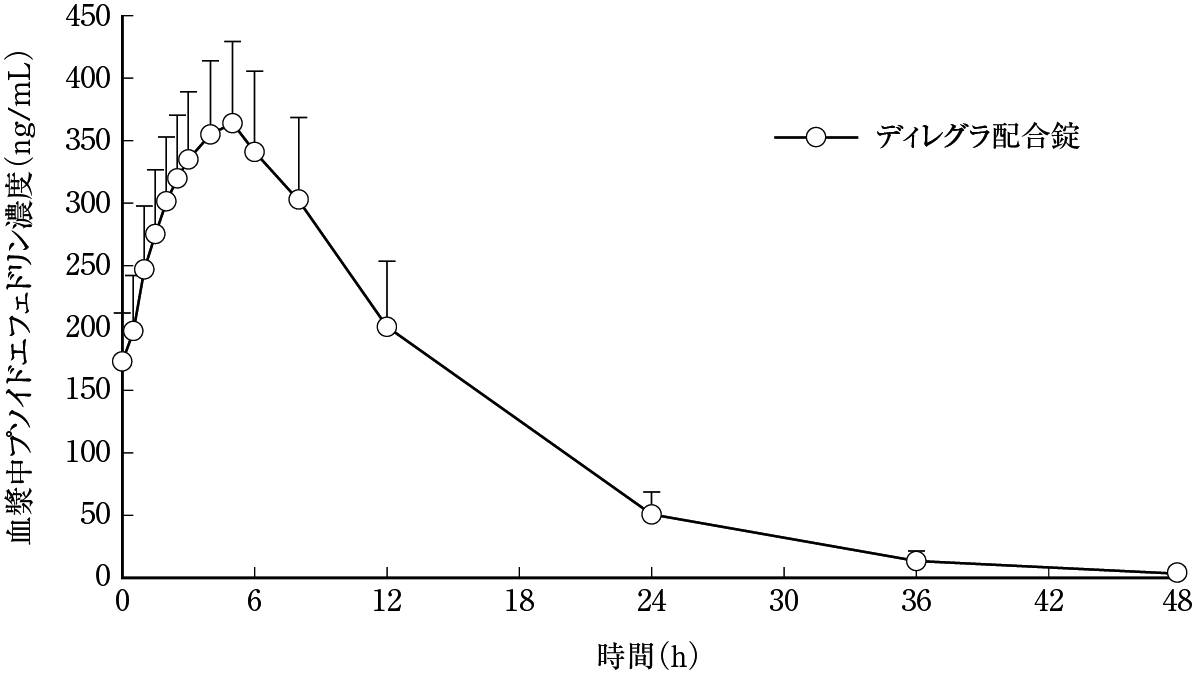
社内資料:FEX/PSE配合錠反復投与時のアレグラ錠に対する相対的バイオアベイラビリティ及び安全性並びに忍容性の検討(2012年12月25日承認、CTD2.7.6.2)
2
社内資料:FEX/PSE配合錠を単回投与したときのバイオアベイラビリティに対する食事の影響の検討(2012年12月25日承認、CTD2.7.6.2)
3
社内資料:健康成人における蛋白結合(2000年9月22日承認、申請資料概要ヘ.II.2.(4))
4
Till, A. E., et al.:J. Pharmacol. Exp. Ther. 1979;211(3):555-560[ALE1506]
5
Kanfer, I., et al.:Pharmacotherapy. 1993;13(6 Pt2):116S-128S[ALE1504]
6
社内資料:健康成人における薬物動態(2000年9月22日承認、申請資料概要ヘ.III(2))
7
社内資料:健康成人における代謝(2000年9月22日承認、申請資料概要ヘ.III(3))
8
Kuntzman, R. G., et al.:Clin. Pharmacol. Ther. 1971;12(1):62-67[ALE1505]
9
社内資料:腎機能障害患者における薬物動態(2000年9月22日承認、申請資料概要ヘ.III.3.(4))
10
社内資料:肝機能障害患者における薬物動態(2000年9月22日承認、申請資料概要ヘ.III.3.(3))
11
社内資料:高齢者における薬物動態(2000年9月22日承認、申請資料概要ヘ.III.3.(2))
12
社内資料:フェキソフェナジンとプソイドエフェドリンの薬物動態学的相互作用の検討(2002年4月15日承認、申請資料概要ヘ.III.3.(2))
13
浦江明憲 他:臨床薬理. 2000;31(5):639-648[ALE0011]
14
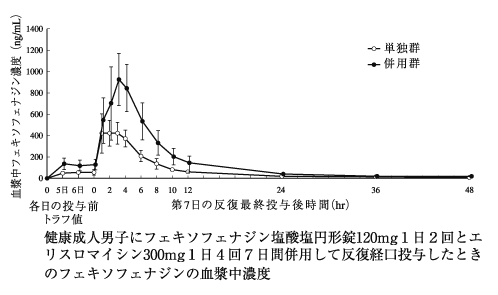
社内資料:エリスロマイシンとの相互作用(2000年9月22日承認、申請資料概要ヘ.III.2.(1))
15
社内資料:オメプラゾール及び水酸化アルミニウムゲル・水酸化マグネシウムとの相互作用(2000年9月22日承認、申請資料概要ヘ.III.2.(3)(4))
16
社内資料:ケトコナゾールとの相互作用(2000年9月22日承認、申請資料概要ヘ.III.2.(2))
17
大久保公裕:アレルギー・免疫. 2012;19(11):1770-1782[ALE1500]
18
社内資料:エリスロマイシンとの相互作用(2000年4月22日承認、申請資料概要ヘ.III.2.(1)、ト.I.5.(1))
19
社内資料:健康成人における高用量の心電図の試験(2000年9月22日承認、申請資料概要ト.I.5.(4))
20
Koss, M. C., et al.:J. Pharmacol. Toxicol. Methods. 2002;47(1):11-17[ALE1507]
21
Koss, M. C., et al.:Am. J. Rhinol. 2002;16(1):49-55[ALE1508]
22
Erickson, C. H., et al.:Am. J. Rhinol. 2001;15(2):83-90[ALE1509]
23
Rudolph, K., et al.:Am. J. Rhinol. 2003;17(4):227-232[ALE1510]
24
Tiniakov, R. L., et al.:J. Appl. Physiol. 2003;94(5):1821-1828[ALE1511]
25
社内資料:薬効薬理の検討
26
Abdelaziz, M. M., et al.:J. Allergy Clin. Immunol. 1998;101(3):410-420[ALE0010]