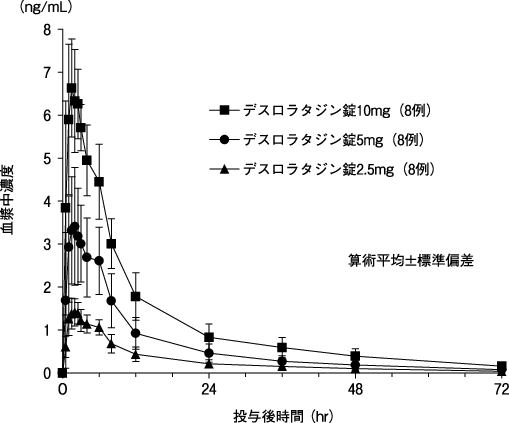
1
Hilbert J, et al. J Clin Pharmacol. 1988;28:234-9.
2
社内資料:日本人での単回及び反復投与試験(2016年9月28日承認、CTD 2.7.2.2)
3
社内資料:食事の影響(2016年9月28日承認、CTD 2.7.1.2)
4
社内資料:分布容積(2016年9月28日承認、CTD 2.7.2.3)
5
社内資料:血漿蛋白結合(2016年9月28日承認、CTD 2.6.4.4)
6
社内資料:マスバランス試験(2016年9月28日承認、CTD 2.7.2.2)
7
社内資料:腎機能障害による影響(2016年9月28日承認、CTD 2.7.2.2)
8
社内資料:肝機能障害による影響(2016年9月28日承認、CTD 2.7.2.2)
9
社内資料:高齢者を含む健康成人を対象とした試験(2016年9月28日承認、CTD 2.7.2.2)
10
社内資料:薬物相互作用試験(薬物動態)(2016年9月28日承認、CTD 2.7.2.2)
11
社内資料:薬物相互作用試験(薬力学)(2016年9月28日承認、CTD 2.7.6.2)
12
社内資料:日中の傾眠及び精神運動機能への影響評価試験(2016年9月28日承認、CTD 2.7.2.2)
13
社内資料:睡眠潜時反復検査(MSLT)評価試験(2016年9月28日承認、CTD 2.7.2.2)
14
社内資料:操縦能力への影響評価試験(2016年9月28日承認、CTD 2.7.2.2)
15
社内資料:自動車運転能力への影響評価試験(2016年9月28日承認、CTD 2.7.2.2)
16
社内資料:高用量心電図試験(2016年9月28日承認、CTD 2.7.2.2)
17
Anthes JC, et al. Eur J Pharmacol. 2002;449:229-37.
18
Kreutner W, et al. Arzneimittelforschung. 2000;50:345-52.
19
Lippert U, et al. Exp Dermatol. 1995;4:272-6.
20
Schroeder JT, et al. Clin Exp Allergy. 2001;31:1369-77.
21
Molet S, et al. Clin Exp Allergy. 1997;27:1167-74.