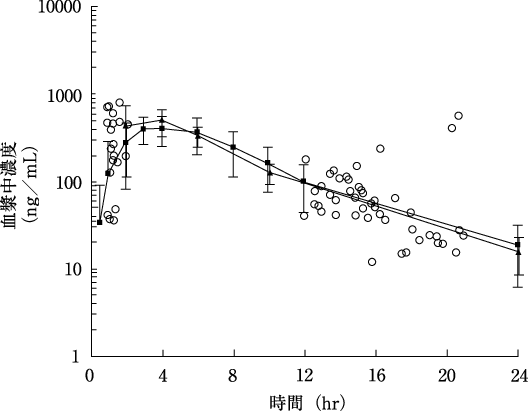
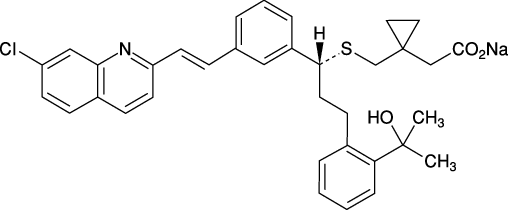
1
Philip G, et al. J Allergy Clin Immunol. 2009;124:691-6.
2
Philip G, et al. J Allergy Clin Immunol. 2009;124:699-706.
3
Migoya E, et al. J Clin Pharmacol. 2004;44:487-94.
4
Knorr B, et al. J Clin Pharmacol. 2001;41:612-9.
5
古庄巻史、他. 臨床医薬. 2005;21:1019-29.
6
社内資料:モンテルカスト細粒剤4mgの食事の影響(2007年7月31日承認、CTD2.7.1.2)
7
社内資料:モンテルカストの蛋白との結合
8
Filppula AM, et al. Drug Metab Dispos. 2011;39:904-11.
9
Karonen T, et al. Br J Clin Pharmacol. 2012;73:257-67.
10
Karonen T, et al. Clin Pharmacol Ther. 2010;88:223-30.
11
Chiba M, et al. Drug Metab Dispos. 1997;25:1022-31.
12
Friedman E, et al. Clin Pharmacol Ther. 2006;79:72.
13
大西明弘、他. 臨床医薬. 2001;17:443-70.
14
Balani SK, et al. Drug Metab Dispos. 1997;25:1282-7.
15
社内資料:モンテルカストの肝機能障害患者における薬物動態
16
Holland S, et al. Clin Pharmacol Ther. 1998;63:231.
17
Malmstrom K, et al. Am J Ther. 1998;5:189-95.
18
Schwartz J, et al. Clin Pharmacol Ther. 1997;61:162.
19
Depré M, et al. J Clin Pharmacol. 1999;39:941-4.
20
Van Hecken A, et al. J Clin Pharmacol. 1999;39:495-500.
21
Jones TR, et al. Can J Physiol Pharmacol. 1995;73:191-201.
22
Diamant Z, et al. Clin Exp Allergy. 1999;29:42-51.
23
社内資料:モンテルカストのアナフィラキシーショックに対する抑制作用
24
宮本昭正、他. 臨床医薬. 2001;17:577-95.
25
Minoguchi K, et al. Chest. 2002;121:732-8.
26
古庄巻史、他. 臨床医薬. 2001;17:609-21.