作成又は改訂年月
※
2013年10月改訂
(第2版、包装の項)
2013年6月作成
(第1版)
日本標準商品分類番号
薬効分類名
承認等
販売名
フェキソフェナジン塩酸塩錠30mg「トーワ」
販売名コード
承認・許可番号
22500AMX00256
FEXOFENADINE HYDROCHLORIDE TABLETS 30mg “TOWA”
薬価基準収載年月
販売開始年月
使用期限等
組成
1錠中の有効成分
日局 フェキソフェナジン塩酸塩…30mg
添加物
乳糖水和物、部分アルファー化デンプン、結晶セルロース、クロスカルメロースNa、ステアリン酸Mg、ヒプロメロース、ヒドロキシプロピルセルロース、タルク、酸化チタン、三二酸化鉄、黄色三二酸化鉄
性状
うすいだいだい色のフィルムコーティング錠
識別コード/本体
Tw343
識別コード/包装
Tw343
外形/表
外形/裏
外形/側面
錠径(mm)
6.0
厚さ(mm)
3.1
質量(mg)
94
販売名
フェキソフェナジン塩酸塩錠60mg「トーワ」
販売名コード
承認・許可番号
22500AMX00255
FEXOFENADINE HYDROCHLORIDE TABLETS 60mg “TOWA”
薬価基準収載年月
販売開始年月
使用期限等
組成
1錠中の有効成分
日局 フェキソフェナジン塩酸塩…60mg
添加物
乳糖水和物、部分アルファー化デンプン、結晶セルロース、クロスカルメロースNa、ステアリン酸Mg、ヒプロメロース、ヒドロキシプロピルセルロース、タルク、酸化チタン、三二酸化鉄、黄色三二酸化鉄
性状
うすいだいだい色の割線入りのフィルムコーティング錠
識別コード/本体
Tw344
識別コード/包装
Tw344
外形/表
外形/裏
外形/側面
錠径(mm)
8.1
厚さ(mm)
3.7
質量(mg)
186
一般的名称
禁忌
効能・効果
アレルギー性鼻炎、蕁麻疹、皮膚疾患(湿疹・皮膚炎、皮膚そう痒症、アトピー性皮膚炎)に伴うそう痒
用法・用量
通常、成人にはフェキソフェナジン塩酸塩として1回60mgを1日2回経口投与する。通常、7歳以上12歳未満の小児にはフェキソフェナジン塩酸塩として1回30mgを1日2回、12歳以上の小児にはフェキソフェナジン塩酸塩として1回60mgを1日2回経口投与する。なお、症状により適宜増減する。
使用上の注意
重要な基本的注意
本剤を季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
本剤の使用により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
制酸剤
水酸化アルミニウム・水酸化マグネシウム含有製剤 | 本剤の作用を減弱させることがあるので、同時に服用させないなど慎重に投与すること。 | 水酸化アルミニウム・水酸化マグネシウムが本剤を一時的に吸着することにより吸収量が減少することによるものと推定される。 |
|---|
| エリスロマイシン | フェキソフェナジン塩酸塩の血漿中濃度を上昇させるとの報告がある。 | P糖蛋白の阻害による本剤のクリアランスの低下及び吸収率の増加に起因するものと推定される。 |
|---|
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用(頻度不明)
ショック、アナフィラキシー:ショック、アナフィラキシーがあらわれることがあるので、観察を十分に行い、呼吸困難、血圧低下、意識消失、血管浮腫、胸痛、潮紅等の過敏症状があらわれた場合には投与を中止し、適切な処置を行うこと。
肝機能障害、黄疸:AST(GOT)、ALT(GPT)、γ-GTP、Al-P、LDHの上昇等の肝機能障害、黄疸があらわれることがあるので、観察を十分に行い異常が認められた場合には、投与を中止し、適切な処置を行うこと。
無顆粒球症、白血球減少、好中球減少:無顆粒球症、白血球減少、好中球減少があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
その他の副作用
精神神経系
頻度不明
頭痛、眠気、疲労、けん怠感、めまい、不眠、神経過敏、悪夢、睡眠障害、しびれ感
消化器
頻度不明
嘔気、嘔吐、口渇、腹痛、下痢、消化不良、便秘
過敏症注1)
頻度不明
血管浮腫、そう痒、蕁麻疹、潮紅、発疹
肝臓注2)
頻度不明
AST(GOT)上昇、ALT(GPT)上昇
腎臓・泌尿器
頻度不明
排尿困難、頻尿
循環器
頻度不明
動悸、血圧上昇
その他
頻度不明
呼吸困難、味覚異常、浮腫、胸痛、月経異常
注1)このような症状があらわれた場合には、投与を中止すること。
注2)このような異常があらわれた場合には、減量、休薬等の適切な処置を行うこと。
高齢者への投与
高齢者では腎機能が低下していることが多く、腎臓からも排泄される本剤では血中濃度が上昇する場合があるので、異常が認められた場合には適切な処置を行うこと。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[妊娠中の投与に関する安全性は確立していない。]
授乳中の女性には本剤投与中は授乳を避けさせること。[動物実験(ラット)で乳汁中へ移行することが報告されている。]
小児等への投与
低出生体重児、新生児、乳児、幼児に対する安全性は確立していない。(使用経験が少ない)
臨床検査結果に及ぼす影響
本剤は、アレルゲン皮内反応を抑制するため、アレルゲン皮内反応検査を実施する3〜5日前から本剤の投与を中止すること。
過量投与
過量投与に関する報告は限られており、外国での過量服用症例報告には用量が不明な症例が多いが、最も高用量を服用した2例(1800〜3600mg)では、症状はないかあるいはめまい、眠気及び口渇が報告されている。過量投与例においては、吸収されずに残っている薬物を通常の方法で除去すること及び、その後の処置は対症的、補助的療法を検討すること。なお、本剤は血液透析によって除去できない。
適用上の注意
薬剤交付時:PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。[PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。]
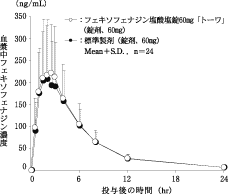
薬物動態
生物学的同等性試験
フェキソフェナジン塩酸塩錠60mg「トーワ」
フェキソフェナジン塩酸塩錠60mg「トーワ」と標準製剤を、クロスオーバー法によりそれぞれ1錠(フェキソフェナジン塩酸塩として60mg)健康成人男子(n=24)に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された1)。
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
フェキソフェナジン塩酸塩錠30mg「トーワ」
フェキソフェナジン塩酸塩錠30mg「トーワ」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成18年11月24日 薬食審査発第1124004号)」に基づき、フェキソフェナジン塩酸塩錠60mg「トーワ」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた2)。
溶出挙動
フェキソフェナジン塩酸塩錠30mg「トーワ」及びフェキソフェナジン塩酸塩錠60mg「トーワ」は、日本薬局方医薬品各条に定められたフェキソフェナジン塩酸塩錠の溶出規格にそれぞれ適合していることが確認されている3)4)。
薬効薬理
抗原抗体反応に伴って起こる肥満細胞からのヒスタミン等のケミカルメディエーターの遊離を抑制すると共に、ヒスタミンのH1作用に拮抗することにより、アレルギー症状を緩和する5)。
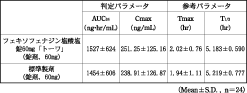
有効成分に関する理化学的知見
構造式:
一般名:フェキソフェナジン塩酸塩(Fexofenadine Hydrochloride)
化学名:2-(4-{(1RS)-1-Hydroxy-4-[4-(hydroxydiphenylmethyl)piperidin-1-yl]butyl}phenyl)-2-methylpropanoic acid monohydrochloride
分子式:C32H39NO4・HCl
分子量:538.12
性 状:白色の結晶性の粉末である。メタノールに極めて溶けやすく、エタノール(99.5)にやや溶けやすく、水に溶けにくい。メタノール溶液(3→100)は旋光性を示さない。結晶多形が認められる。
取扱い上の注意
注意
光により退色することがある。
安定性試験
最終包装製品を用いた加速試験(40℃、相対湿度75%、6ヵ月)の結果、フェキソフェナジン塩酸塩錠30mg「トーワ」及びフェキソフェナジン塩酸塩錠60mg「トーワ」は通常の市場流通下においてそれぞれ3年間安定であることが推測された6)7)。
包装
フェキソフェナジン塩酸塩錠30mg「トーワ」:100錠(PTP)
フェキソフェナジン塩酸塩錠60mg「トーワ」:
※100錠、500錠(PTP)
140錠(14錠×10:PTP)
※700錠(14錠×50:PTP)
300錠(バラ)
主要文献
1
東和薬品株式会社 社内資料:生物学的同等性試験(錠60mg)
2
東和薬品株式会社 社内資料:生物学的同等性試験(錠30mg)
3
東和薬品株式会社 社内資料:溶出試験(錠30mg)
4
東和薬品株式会社 社内資料:溶出試験(錠60mg)
5
第十六改正日本薬局方解説書, C-3867, 2011
6
東和薬品株式会社 社内資料:安定性試験(錠30mg)
7
東和薬品株式会社 社内資料:安定性試験(錠60mg)
文献請求先・製品情報お問い合わせ先
主要文献(社内資料を含む)は下記にご請求下さい。
東和薬品株式会社 学術部DIセンター(24時間受付対応)
〒571-8580 大阪府門真市新橋町2番11号

0120-108-932 TEL 06-6900-9108 FAX 06-6908-5797
http://www.towayakuhin.co.jp/forstaff
製造販売業者等の氏名又は名称及び住所
製造販売元
東和薬品株式会社
大阪府門真市新橋町2番11号
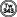





 0120-108-932 TEL 06-6900-9108 FAX 06-6908-5797
0120-108-932 TEL 06-6900-9108 FAX 06-6908-5797