作成又は改訂年月
**
2022年7月改訂
(第3版、承認条件削除)
*
2019年11月改訂
日本標準商品分類番号
日本標準商品分類番号等
2019年11月
薬効分類名
選択的ヒスタミンH1受容体拮抗・アレルギー性疾患治療剤
承認等
販売名
ベポタスチンベシル酸塩錠5mg「サワイ」
販売名コード
承認・許可番号
23000AMX00351000
BEPOTASTINE BESILATE
薬価基準収載年月
販売開始年月
貯法・使用期限等
基準名
組成
ベポタスチンベシル酸塩錠5mg「サワイ」:1錠中に日局ベポタスチンベシル酸塩5mgを含有する。
添加物として、カルナウバロウ、酸化チタン、ステアリン酸Mg、タルク、トレハロース、ヒドロキシプロピルセルロース、ヒプロメロース、部分アルファー化デンプン、D-マンニトールを含有する。
組成及び性状の表
| 剤形 | 直径(mm) | 重量(mg) | 厚さ(mm) | 性状 | 識別コード | 外形 |
| フィルムコーティング錠 | 5.6 | 約63 | 2.5 | 白色 | SW BT5 |  |
販売名
ベポタスチンベシル酸塩錠10mg「サワイ」
販売名コード
承認・許可番号
23000AMX00352000
BEPOTASTINE BESILATE
薬価基準収載年月
販売開始年月
貯法・使用期限等
基準名
組成
ベポタスチンベシル酸塩錠10mg「サワイ」:1錠中に日局ベポタスチンベシル酸塩10mgを含有する。
添加物として、カルナウバロウ、酸化チタン、ステアリン酸Mg、タルク、トレハロース、ヒドロキシプロピルセルロース、ヒプロメロース、部分アルファー化デンプン、D-マンニトールを含有する。
組成及び性状の表
| 剤形 | 直径(mm) | 重量(mg) | 厚さ(mm) | 性状 | 識別コード | 外形 |
| 割線入りフィルムコーティング錠 | 7.1 | 約125 | 3.0 | 白色 | SW BT10 |  |
禁忌
*効能又は効果
〈成人〉
アレルギー性鼻炎、蕁麻疹、皮膚疾患に伴うそう痒(湿疹・皮膚炎、痒疹、皮膚そう痒症)
〈小児〉
アレルギー性鼻炎、蕁麻疹、皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒
*用法及び用量
〈成人〉
通常、成人にはベポタスチンベシル酸塩として1回10mgを1日2回経口投与する。
なお、年齢、症状により適宜増減する。
〈小児〉
通常、7歳以上の小児にはベポタスチンベシル酸塩として1回10mgを1日2回経口投与する。
使用上の注意
慎重投与
腎機能障害のある患者〔本剤の血中濃度を上昇させることがある。また、高い血中濃度が持続するおそれがあるので、低用量(例えば1回量5mg)から投与するなど慎重に投与し、異常が認められた場合は減量、休薬するなど適切な処置を行う。〕
重要な基本的注意
眠気を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械を操作する際には注意させること。
長期ステロイド療法を受けている患者で、本剤投与によりステロイドの減量を図る場合には十分な管理下で徐々に行うこと。
本剤を季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
本剤の使用により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
| 頻度不明 |
| 血液 | 白血球数増加、白血球数減少、好酸球増多 |
| 精神神経系 | 眠気、倦怠感、頭痛、頭重感、めまい |
| 消化器 | 口渇、悪心、胃痛、胃部不快感、下痢、口内乾燥、舌炎、嘔吐、腹痛、便秘 |
| 過敏症 | 発疹、腫脹、蕁麻疹 |
| 肝臓 | AST(GOT)、ALT(GPT)、γ-GTP、LDH、総ビリルビンの上昇 |
| 腎臓 | 尿潜血、尿蛋白、尿糖、尿ウロビリノーゲン、尿量減少、排尿困難、尿閉 |
| その他 | 月経異常、浮腫、動悸、呼吸困難、しびれ、味覚異常 |
副作用が認められた場合には、投与を中止するなど適切な処置を行うこと。
高齢者への投与
本剤は、主として腎臓から排泄されるが、一般に高齢者では生理機能が低下していることが多いため高い血中濃度が持続するおそれがあるので注意すること。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には、投与しないことが望ましいが、やむを得ず投与する場合には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。〔妊娠中の投与に関する安全性は確立しておらず、また、動物実験で胎児への移行が認められている。〕
授乳中の婦人には投与しないことが望ましいが、やむを得ず本剤を投与する場合には授乳を避けさせること。〔動物実験(ラット)で乳汁中への移行が報告されている。〕
*小児等への投与
低出生体重児、新生児、乳児又は幼児に対する安全性は確立していない(使用経験が少ない)。1)
適用上の注意
薬剤交付時:PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている)
薬物動態
1.生物学的同等性試験
○ベポタスチンベシル酸塩錠5mg「サワイ」
ベポタスチンベシル酸塩錠5mg「サワイ」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成24年2月29日付 薬食審査発0229第10号)」に基づき、ベポタスチンベシル酸塩錠10mg「サワイ」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた。2)
○ベポタスチンベシル酸塩錠10mg「サワイ」
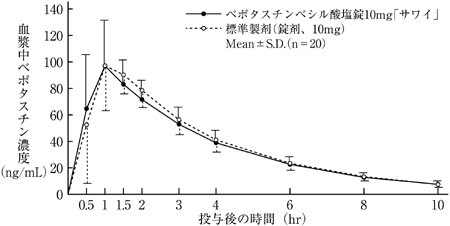
ベポタスチンベシル酸塩錠10mg「サワイ」と標準製剤を健康成人男子にそれぞれ1錠(ベポタスチンベシル酸塩として10mg)空腹時単回経口投与(クロスオーバー法)し、血漿中ベポタスチン濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。3)
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
2.溶出挙動
本製剤は、日本薬局方に定められた溶出規格に適合していることが確認されている。
| | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-10hr(ng・hr/mL) |
| ベポタスチンベシル酸塩錠10mg「サワイ」 | 105.8±26.3 | 1.2±0.7 | 2.5±0.3 | 365.9±45.8 |
| 標準製剤(錠剤、10mg) | 109.1±26.1 | 1.2±0.3 | 2.4±0.3 | 378.1±52.3 |
薬効薬理
ベポタスチンは、ヒスタミンH1受容体拮抗作用を主体とし、ケミカルメディエーター(ロイコトリエン、トロンボキサン、PAF等)の産生・遊離抑制作用を現す。好酸球浸潤・増多抑制やインターロイキン-5の産生抑制も示唆されている。4)
有効成分に関する理化学的知見
一般名
ベポタスチンベシル酸塩(Bepotastine Besilate)
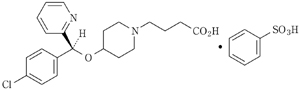
化学名
(S)-4-{4-[(4-Chlorophenyl)(pyridin-2-yl)methoxy]piperidin-1-yl}butanoic acid monobenzenesulfonate
分子式
C21H25ClN2O3・C6H6O3S
分子量
547.06
融点
159〜163℃
構造式
性状
ベポタスチンベシル酸塩は白色〜微黄白色の結晶又は結晶性の粉末である。酢酸(100)に極めて溶けやすく、水又はエタノール(99.5)にやや溶けにくい。1gを水100mLに溶かした液のpHは約3.8である。
取扱い上の注意
・安定性試験
PTP包装(PTPシートをアルミピロー包装(乾燥剤入り))したものを用いた加速試験(40℃75%RH、6ヶ月)の結果、通常の市場流通下において3年間安定であることが推測された。5)、6)
包装
ベポタスチンベシル酸塩錠5mg「サワイ」:
PTP:100錠(10錠×10)
ベポタスチンベシル酸塩錠10mg「サワイ」:
PTP:100錠(10錠×10)、140錠(14錠×10)、500錠(10錠×50)
主要文献及び文献請求先
*主要文献
1
馬場駿吉,臨床医薬,18(12),1371(2002).
2
沢井製薬(株)社内資料[生物学的同等性試験]
3
花田隆造他,診療と新薬,55(4),296(2018).
4
第十七改正日本薬局方解説書,廣川書店,2016,C-5025.
5
沢井製薬(株)社内資料[安定性試験]
6
沢井製薬(株)社内資料[安定性試験]
**文献請求先
〔主要文献(社内資料を含む)は下記にご請求下さい〕
沢井製薬株式会社 医薬品情報センター
〒532-0003 大阪市淀川区宮原5丁目2-30
TEL:0120-381-999
FAX:06-7708-8966
製造販売業者等の氏名又は名称及び住所
製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30