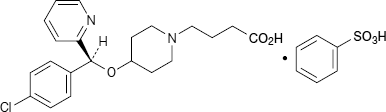
選択的ヒスタミンH1受容体拮抗・アレルギー性疾患治療剤
1錠 10.7円
| 性状・剤形 | 白色・フィルムコーティング錠 |
|---|---|
| 外形 | 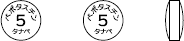 |
| 規格 | 直径(mm)6.1 厚さ(mm)2.7 重量(mg)84 |
| 本体表示 | ベポタスチン5タナベ |
| 性状・剤形 | 白色・フィルムコーティング錠(割線入) |
|---|---|
| 外形 | 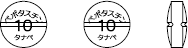 |
| 規格 | 直径(mm)7.1 厚さ(mm)3.0 重量(mg)125 |
| 本体表示 | ベポタスチン10タナベ |
| 投与量 (mg) | Tmax (hr) | Cmax (ng/mL) | AUC0-∞ (ng・hr/mL) | t1/2 (hr) |
| 2.5 | 0.8±0.1 | 22.4±2.1 | 113.7±7.0 | 3.3±0.3 |
| 5 | 1.2±0.2 | 46.2±4.0 | 203.6±6.7 | 2.5±0.1 |
| 10 | 1.2±0.2 | 101.3±3.5 | 438.6±29.1 | 2.4±0.1 |
| 20 | 1.5±0.3 | 199.5±13.1 | 879.7±60.6 | 2.3±0.1 |
| 40 | 1.6±0.3 | 393.6±23.7 | 1916.4±81.1 | 2.9±0.2 |
| 通年性アレルギー性 鼻炎患者 C1-3hr | 通年性アレルギー性 鼻炎患者 C9-11hr | アトピー性 皮膚炎患者 C9-11hr | |
| 平均値±標準偏差 (例数) | 92.0±56.1 (62) | 8.2±4.0 (43) | 8.3±4.1 (106) |
| 腎機能障害患者の分類 (クレアチニンクリアランス) | Tmax (hr) | Cmax (ng/mL) | t1/2 (hr) | AUC0-∞ (ng・hr/mL) |
| 腎機能正常者(n=5) (>70mL/min) | 1.2±0.4 | 55.1±16.8 | 2.9±0.5 | 241.1±50.6 |
| 軽度腎機能障害患者(n=5) (51〜70mL/min) | 1.0±0.0 | 61.0±10.8 | 3.1±0.6 | 304.0±61.7 |
| 中等度又は高度腎機能障害患者(n=6) (6〜50mL/min) | 3.3±1.0 | 66.3±7.7 | 8.5±3.6 | 969.1±398.3 |