作成又は改訂年月
**
2016年10月改訂
(第11版)
*
2013年10月改訂
日本標準商品分類番号
日本標準商品分類番号等
*用法・用量追加 2013年10月(5mg)
薬効分類名
承認等
販売名
セチリジン塩酸塩錠5mg「NPI」
販売名コード
承認・許可番号
21900AMX01013000
Cetirizine
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
密閉容器(室温保存)
使用期限:
外装に表示 (3年)
基準名
組成
1錠中の有効成分
(日局) セチリジン塩酸塩 5.0mg
添加物
カルナウバロウ、含水二酸化ケイ素、結晶セルロース、酸化チタン、ステアリン酸マグネシウム、低置換度ヒドロキシプロピルセルロース、乳糖水和物、ヒプロメロース、マクロゴール6000
性状
白色のフィルムコーティング錠
サイズ 直径 (mm)
6.1
サイズ 厚さ(mm)
2.9
重量 (mg)
88
表
裏
側面
識別コード
NPI 102
販売名
セチリジン塩酸塩錠10mg「NPI」
販売名コード
承認・許可番号
21900AMX01014000
Cetirizine
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
密閉容器(室温保存)
使用期限:
外装に表示 (3年)
基準名
組成
1錠中の有効成分
(日局) セチリジン塩酸塩 10.0mg
添加物
カルナウバロウ、含水二酸化ケイ素、結晶セルロース、酸化チタン、ステアリン酸マグネシウム、低置換度ヒドロキシプロピルセルロース、乳糖水和物、ヒプロメロース、マクロゴール6000
性状
白色のフィルムコーティング錠
サイズ 直径 (mm)
7.1
サイズ 厚さ(mm)
3.0
重量 (mg)
119
表
裏
側面
識別コード
NPI 103
禁忌
本剤の成分又はピペラジン誘導体 (レボセチリジン、ヒドロキシジンを含む) に対し過敏症の既往歴のある患者
重度の腎障害 (クレアチニンクリアランス10mL/min未満) のある患者
[高い血中濃度が持続するおそれがある。]
効能又は効果
*〔成人〕
アレルギー性鼻炎
蕁麻疹、湿疹・皮膚炎、痒疹、皮膚そう痒症
*〔小児〕
アレルギー性鼻炎
蕁麻疹、皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒
用法及び用量
*〔10mg錠〕
通常、成人にはセチリジン塩酸塩として1回10mgを1日1回、就寝前に経口投与する。
なお、年齢、症状により適宜増減するが、最高投与量は1日20mgとする。
*〔5mg錠〕
〔成人〕
通常、成人にはセチリジン塩酸塩として1回10mgを1日1回、就寝前に経口投与する。
なお、年齢、症状により適宜増減するが、最高投与量は1日20mgとする。
*〔小児〕
通常、7歳以上15歳未満の小児にはセチリジン塩酸塩として1回5mgを1日2回、朝食後及び就寝前に経口投与する。
用法及び用量に関連する使用上の注意
腎障害患者では、血中濃度半減期の延長が認められ、血中濃度が増大するため、クレアチニンクリアランスに応じて、下表のとおり投与量の調節が必要である。なお、クレアチニンクリアランスが10mL/min未満の患者への投与は禁忌である。
成人患者の腎機能に対応する用法及び用量の目安 (外国人データ)

*腎障害を有する小児患者では、各患者の腎クリアランスと体重を考慮して、個別に用量を調整すること。
使用上の注意
慎重投与
腎障害のある患者
[高い血中濃度が持続するおそれがある。(「用法及び用量に関連する使用上の注意」の項参照)]
肝障害のある患者
[高い血中濃度が持続するおそれがある。]
高齢者
[高い血中濃度が持続するおそれがある。 (「高齢者への投与」の項参照)]
てんかん等の痙攣性疾患又はこれらの既往歴のある患者
[痙攣を発現するおそれがある。]
重要な基本的注意
眠気を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作には従事させないよう十分注意すること。
本剤を季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
本剤の使用により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
| テオフィリン | 併用により、テオフィリンの薬物動態に変化はないが、セチリジン塩酸塩の曝露量の増加が報告されている。 | 機序は明らかではないが、セチリジン塩酸塩のクリアランスが16%減少する。 |
|---|
| リトナビル | 併用により、セチリジン塩酸塩の曝露量の増加 (40%) 及びリトナビルの曝露量のわずかな変化 (−11%) が報告されている。 | リトナビルによりセチリジン塩酸塩の腎排泄が阻害される可能性が考えられる。 |
|---|
中枢神経抑制剤
アルコール | 中枢神経系に影響を与える可能性があるため、中枢神経抑制剤あるいはアルコールと併用する際は注意すること。 | 中枢神経抑制作用が増強される可能性がある。 |
|---|
| ピルシカイニド塩酸塩水和物 | 併用により両剤の血中濃度が上昇し、ピルシカイニド塩酸塩水和物の副作用が発現したとの報告がある。 | 機序は明らかではない。 |
|---|
副作用
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
**ショック、アナフィラキシー
(頻度不明)
ショック、アナフィラキシー (呼吸困難、血圧低下、蕁麻疹、発赤等) があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
痙攣
(頻度不明)
異常が認められた場合には、投与を中止し、適切な処置を行うこと。
肝機能障害、黄疸
(頻度不明)
AST (GOT)、ALT (GPT)、γ-GTP、LDH、Al-Pの上昇等の肝機能障害 (初期症状: 全身倦怠感、食欲不振、発熱、嘔気等)、黄疸があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
血小板減少
(頻度不明)
血小板減少があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
その他の副作用
**精神神経系
(頻度不明)
眠気、倦怠感、頭痛、頭重感、ふらふら感、しびれ感、めまい、浮遊感、不眠、振戦、抑うつ、激越、攻撃性、無力症、錯感覚、幻覚、不随意運動、意識消失、健忘、自殺念慮、悪夢
消化器
(頻度不明)
口渇、嘔気、食欲不振、胃不快感、下痢、消化不良、腹痛、腹部不快感、胃痛、口唇炎、便秘、口唇乾燥感、嘔吐、味覚異常、口内炎、腹部膨満感、食欲亢進
循環器
(頻度不明)
動悸、血圧上昇、不整脈 (房室ブロック、期外収縮、頻脈、発作性上室性頻拍、心房細動)
血液
(頻度不明)
好酸球増多、好中球減少、リンパ球増多、白血球増多、白血球減少、単球増多、血小板増加、血小板減少
過敏症
(頻度不明)
発疹、蕁麻疹、浮腫、かぶれ、そう痒感、血管浮腫、多形紅斑
眼
(頻度不明)
結膜充血、霧視、眼球回転発作
肝臓
(頻度不明)
ALT (GPT) 上昇、AST (GOT) 上昇、総ビリルビン上昇、Al-P上昇
腎臓・泌尿器
(頻度不明)
尿蛋白、BUN上昇、尿糖、ウロビリノーゲンの異常、頻尿、血尿、排尿困難、遺尿、尿閉
その他
(頻度不明)
耳鳴、月経異常、胸痛、ほてり、息苦しさ、関節痛、手足のこわばり、嗅覚異常、鼻出血、脱毛、咳嗽、体重増加、筋肉痛
以上のような副作用が認められた場合には、必要に応じ、減量、投与中止等の適切な処置を行うこと。
高齢者への投与
本剤は、主として腎臓から排泄されるが、高齢者では腎機能が低下していることが多く、高い血中濃度が持続するおそれがあるので、低用量 (例えば5mg) から投与を開始するなど慎重に投与し、異常が認められた場合は減量又は休薬するなど適切な処置を行うこと。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
[動物実験 (ラット) で胎盤を通過することが報告されている。]
授乳中の婦人には本剤投与中は授乳を避けさせること。
[ヒト乳汁中へ移行することが報告されている。]
小児等への投与
**2歳以上7歳未満の小児に対してはセチリジン塩酸塩ドライシロップ1.25%を投与すること。
*低出生体重児、新生児、乳児又は2歳未満の幼児に対する安全性は確立していない (国内における使用経験が少ない)。
臨床検査結果に及ぼす影響
本剤は、アレルゲン皮内反応を抑制するため、アレルゲン皮内反応検査を実施する3〜5日前より本剤の投与を中止することが望ましい。
過量投与
徴候、症状:
本剤の過量投与により錯乱、散瞳、落ち着きのなさ、鎮静、傾眠、昏迷、尿閉があらわれることがある。
処置:
必要に応じ対症療法を行うこと。本剤の特異的な解毒剤はなく、また本剤は透析で除去されない。
適用上の注意
薬剤交付時:
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。
[PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。]
薬物動態
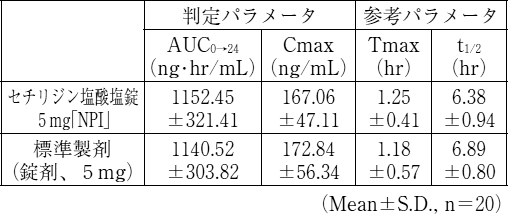
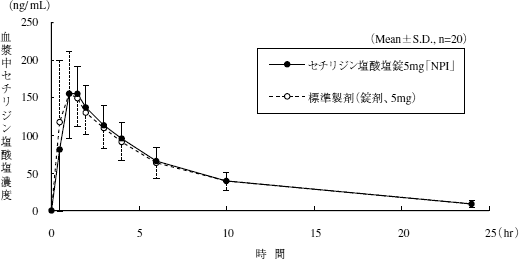
生物学的同等性試験
セチリジン塩酸塩錠5mg「NPI」又はセチリジン塩酸塩錠10mg「NPI」とそれぞれの標準製剤を、クロスオーバー法によりそれぞれ1錠 (セチリジン塩酸塩5mg又はセチリジン塩酸塩10mg) 健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ (AUC、Cmax) について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
1)1) セチリジン塩酸塩錠5mg「NPI」
2) セチリジン塩酸塩錠10mg「NPI」
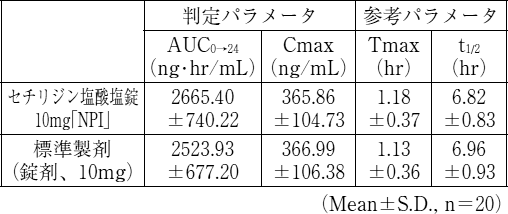
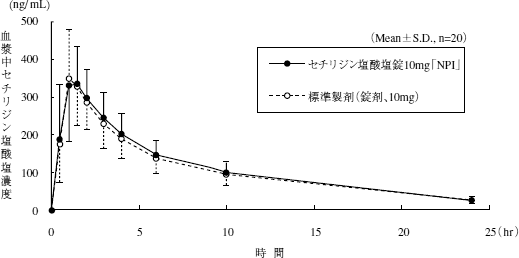
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
**溶出挙動
セチリジン塩酸塩錠5mg「NPI」及びセチリジン塩酸塩錠10mg「NPI」は、日本薬局方医薬品各条に定められたセチリジン塩酸塩錠の溶出規格に適合していることが確認されている。2)
薬効薬理
**セチリジン塩酸塩は、抗ヒスタミン薬 (H1受容体遮断薬) であるが、ロイコトリエン及びプロスタグランジンD2の遊離抑制作用を併せ持つ。古典的な抗ヒスタミン薬と異なり、抗コリン作用はほとんどない。また、ヒスタミンH2、ドパミン、セロトニンの各受容体に対する親和性は低く、中枢神経系におけるヒスタミンH1受容体への影響が少ないとされる。3)
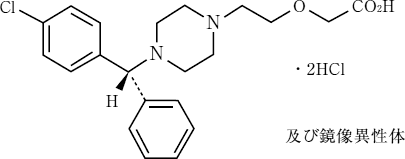
有効成分に関する理化学的知見
一般名:
セチリジン塩酸塩 (Cetirizine Hydrochloride)
化学名:
2-(2-{4-[(RS )-(4-Chlorophenyl) (phenyl) methyl]piperazin-1-yl}ethoxy) acetic acid dihydrochloride
分子式:
C21H25ClN2O3・2HCl
分子量:
461.81
構造式:
性状:
セチリジン塩酸塩は白色の結晶性の粉末である。
本品は水に極めて溶けやすく、エタノール (99.5) に溶けにくい。
本品は0.1mol/L塩酸試液に溶ける。
本品の水溶液 (1→10) は旋光性を示さない。
取扱い上の注意
安定性試験
PTP包装を用いた加速試験 (40℃、相対湿度75%、6ヵ月) の結果、セチリジン塩酸塩錠5mg「NPI」及びセチリジン塩酸塩錠10mg「NPI」は通常の市場流通下において3年間安定であることが推測された。4)
包装
セチリジン塩酸塩錠5mg「NPI」: 100錠 (10錠×10)
セチリジン塩酸塩錠10mg「NPI」: 100錠 (10錠×10)
500錠 (10錠×50)
主要文献及び文献請求先
主要文献
1
日本薬品工業株式会社: 生物学的同等性に関する資料 (社内資料)
2
**日本薬品工業株式会社: 溶出に関する資料 (社内資料)
3
**第十七改正日本薬局方解説書 C-2556,廣川書店,東京,2016
4
日本薬品工業株式会社: 安定性に関する資料 (社内資料)
資料請求先
主要文献に記載の社内資料につきましても下記にご請求ください。
日本薬品工業株式会社 安全管理課
〒101-0032 東京都千代田区岩本町2丁目2番3号
TEL 03-5833-5011
FAX 03-5833-5100
製造販売業者等の氏名又は名称及び住所
製造販売元
日本薬品工業株式会社
東京都千代田区岩本町2丁目2-3