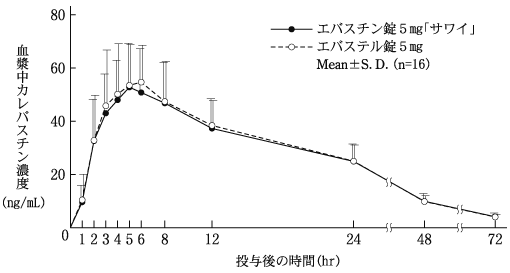
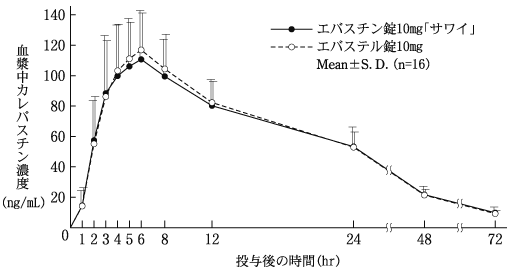
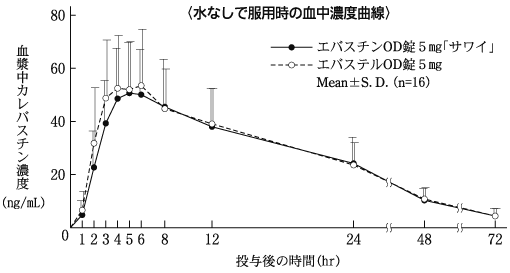
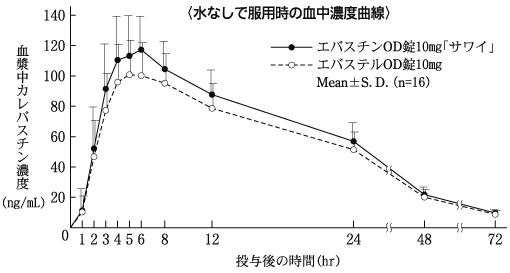
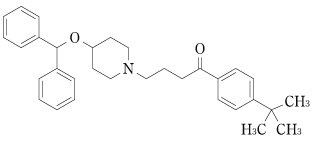
1
Yamaguchi, T. et al.:Arzneim.-Forsch./Drug Res., 1994;44:59-64
2
水山和之他:医学と薬学, 2008;59(5):821-830
3
水山和之:医学と薬学, 2008;59(6):975-985
4
Fujii, T. et al.:Arzneim.-Forsch./Drug Res., 1994;44:527-538
5
第十八改正日本薬局方解説書, 廣川書店, 2021;C-993-997
6
橋爪孝典:Progress in Medicine, 2003;23:282-287
7
Hashizume, T. et al.:J. Pharmacol. Exp. Ther., 2002;300:298-304
8
長澤絋一他:臨床医薬, 1995;11:1213-1226
9
久木田淳他:臨床医薬, 1994;10(Suppl. 1):55-72
10
馬場駿吉他:臨床医薬, 1994;10(Suppl. 1):125-145
11
久木田淳他:臨床医薬, 1994;10:895-912
12
馬場駿吉他:臨床医薬, 1994;10:1143-1162
13
久木田淳他:臨床医薬, 1994;10(Suppl. 1):43-53
14
久木田淳他:臨床医薬, 1994;10(Suppl. 1):89-102
15
久木田淳他:臨床医薬, 1994;10(Suppl. 1):73-88
16
馬場駿吉他:臨床医薬, 1994;10(Suppl. 1):113-124
17
馬場駿吉他:臨床医薬, 1994;10(Suppl. 1):177-188
18
馬場駿吉他:臨床医薬, 1994;10(Suppl. 1):163-176
19
馬場駿吉他:臨床医薬, 1994;10(Suppl. 1):147-161
20
薬王郁久他:日本薬理学雑誌, 1994;103:121-135
21
久木田淳他:臨床医薬, 1994;10(Suppl. 1):103-111