作成又は改訂年月
**
2021年3月改訂
(第9版)
*
2016年4月改訂
日本標準商品分類番号
薬効分類名
承認等
販売名
エバスチン錠5mg「NS」
販売名コード
承認・許可番号
22000AMX01175000
Ebastine Tablets 5mg“NS”
薬価基準収載年月
販売開始年月
貯法・使用期限等
基準名
組成
有効成分・含量(1錠中)
エバスチン錠5mg「NS」は、1錠中に日本薬局方エバスチン5mgを含有
添加物
部分アルファー化デンプン、結晶セルロース、ヒドロキシプロピルセルロース、クロスポビドン、ステアリン酸マグネシウム、ヒプロメロース、タルク、酸化チタン、マクロゴール6000、カルナウバロウ
性状
| 性状 | 白色のフィルムコーティング錠 |
|---|
| 外形 |  |
|---|
| 大きさ | 錠径:6.1mm 錠厚:3.1mm 重量:90mg |
|---|
| 識別コード | NS416 |
|---|
販売名
エバスチン錠10mg「NS」
販売名コード
承認・許可番号
22000AMX01176000
Ebastine Tablets 10mg“NS”
薬価基準収載年月
販売開始年月
貯法・使用期限等
基準名
組成
有効成分・含量
エバスチン錠10mg「NS」は、1錠中に日本薬局方エバスチン10mgを含有
添加物
部分アルファー化デンプン、結晶セルロース、ヒドロキシプロピルセルロース、クロスポビドン、ステアリン酸マグネシウム、ヒプロメロース、タルク、酸化チタン、マクロゴール6000、カルナウバロウ
性状
| 性状 | 片面割線入りのキャプレット型の白色のフィルムコーティング錠 |
|---|
| 外形 |  |
|---|
| 大きさ | 長径:10.2mm 短径:5.1mm 錠厚:3.7mm 重量:180mg |
|---|
| 識別コード | NS417 |
|---|
禁忌
効能又は効果
蕁麻疹
湿疹・皮膚炎、痒疹、皮膚そう痒症
アレルギー性鼻炎
用法及び用量
通常、成人には、エバスチンとして1回5〜10mgを1日1回経口投与する。
なお、年齢・症状により適宜増減する。
使用上の注意
慎重投与
肝障害又はその既往歴のある患者[肝機能異常があらわれるおそれがある。]
重要な基本的注意
1眠気を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に注意させること。
2長期ステロイド療法を受けている患者で本剤投与によりステロイドの減量をはかる場合は、十分な管理下で徐々に行うこと。
3本剤を季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
相互作用
本剤は、主として代謝酵素CYP2J2及びCYP3A4で代謝される。
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
| エリスロマイシン | 本剤の代謝物カレバスチンの血漿中濃度が約2倍に上昇することが報告されている。 | カレバスチンの代謝が抑制されると考えられる。 |
|---|
| イトラコナゾール | 本剤の代謝物カレバスチンの血漿中濃度が上昇することが報告されている。 | カレバスチンの代謝が抑制されると考えられる。 |
|---|
| リファンピシン | 本剤の代謝物カレバスチンの血漿中濃度が低下することが報告されている。 | カレバスチンの代謝が促進されると考えられる。 |
|---|
副作用
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
1*ショック、アナフィラキシー(頻度不明)
ショック、アナフィラキシーがあらわれることがあるので、観察を十分に行い、血圧低下、呼吸困難、喉頭浮腫等の症状が認められた場合には、投与を中止し、適切な処置を行うこと。
2肝機能障害、黄疸(頻度不明)
AST(GOT)、ALT(GPT)、LDH、γ-GTP、Al-P、ビリルビンの上昇等を伴う肝機能障害、黄疸があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
重大な副作用(類薬)
類薬(テルフェナジン等)で、QT延長、心室性不整脈(Torsades de pointesを含む)があらわれるとの報告がある。
その他の副作用
1過敏症注)
頻度不明
発疹、浮腫、蕁麻疹
2循環器
頻度不明
動悸、血圧上昇
3精神神経系
頻度不明
眠気、けん怠感、頭痛、めまい、しびれ感、不眠
4消化器
頻度不明
口渇、胃部不快感、嘔気・嘔吐、腹痛、鼻・口腔内乾燥、下痢、舌炎
5肝臓
頻度不明
AST(GOT)、ALT(GPT)、LDH、γ-GTP、Al-P、ビリルビンの上昇
6泌尿器
頻度不明
排尿障害、頻尿
7その他
頻度不明
好酸球増多、胸部圧迫感、ほてり、体重増加、月経異常、脱毛、味覚異常、BUNの上昇、尿糖
注)このような症状があらわれた場合には、投与を中止すること。
高齢者への投与
1日1回5mgから投与するなど注意すること。[一般に高齢者では生理機能が低下している。]
妊婦、産婦、授乳婦等への投与
1妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[妊娠中の投与に関する安全性は確立していない。]
2本剤投与中は授乳を避けさせること。[動物実験(ラット)で乳汁中への移行が報告されている。]
小児等への投与
低出生体重児、新生児、乳児又は幼児に対する安全性は確立していない(使用経験が少ない)。
臨床検査結果に及ぼす影響
本剤はアレルゲン皮内反応を抑制するため、アレルゲン皮内反応検査を実施する前は、本剤を投与しないこと。
適用上の注意
薬剤交付時:PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている)。
薬物動態
1生物学的同等性試験1)
(1)
エバスチン錠5mg「NS」と標準製剤を、クロスオーバー法によりそれぞれ2錠(エバスチンとして10mg)健康成人男子に絶食時単回経口投与して活性代謝物カレバスチンの血漿中濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.8)〜log(1.25)の範囲内であり、両製剤の生物学的同等性が確認された。
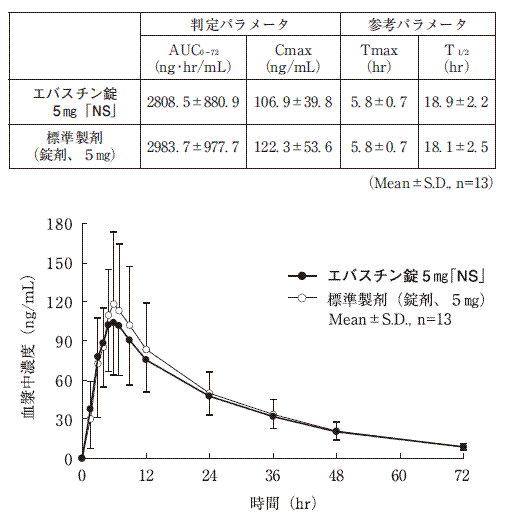
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
(2)
エバスチン錠10mg「NS」と標準製剤を、クロスオーバー法によりそれぞれ1錠(エバスチンとして10mg)健康成人男子に絶食時単回経口投与して活性代謝物カレバスチンの血漿中濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.8)〜log(1.25)の範囲内であり、両製剤の生物学的同等性が確認された。
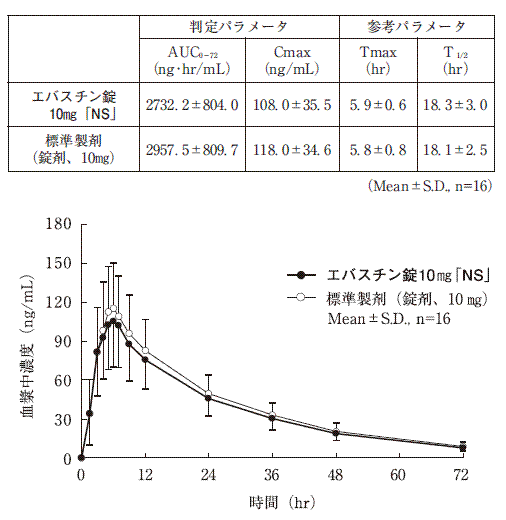
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
溶出挙動1)
エバスチン錠5mg「NS」及びエバスチン錠10mg「NS」は、それぞれ日本薬局方医薬品各条に定められたエバスチン錠の溶出規格に適合していることが確認されている。
薬効薬理
エバスチンはH1受容体を介するヒスタミンによるアレルギー性反応(毛細血管の拡張と透過性亢進、気管支平滑筋の収縮、知覚神経終末刺激によるそう痒、など)を抑制する。これに加えて、ケミカルメディエーター遊離抑制作用を有する点が、古典的抗ヒスタミン薬とは異なる。なお、エバスチンの作用の大部分は活性代謝物のカレバスチンの作用である。2)
有効成分に関する理化学的知見
一般名
エバスチン(Ebastine)
化学名
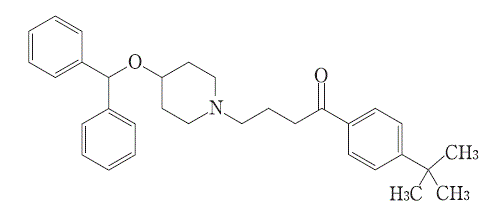
1-[4-(1,1-Dimethylethyl)phenyl]-4-[4-(diphenylmethoxy)piperidin-1-yl]butan-1-one
分子式
C32H39NO2
分子量
469.66
構造式
性 状
本品は白色の結晶又は結晶性の粉末である。酢酸(100)に溶けやすく、メタノールにやや溶けやすく、エタノール(95)にやや溶けにくく、水にほとんど溶けない。
本品は光によって徐々に帯黄白色となる。
融 点
84〜87℃
取扱い上の注意
安定性試験3)
エバスチン錠5mg「NS」及びエバスチン錠10mg「NS」は、最終包装製品を用いた加速試験(40℃、相対湿度75%、6ヵ月)の結果、室温保存において3年間安定であることが推測された。また、最終包装製品を用いた長期保存試験(室温保存、3年)の結果、外観及び含量等は規格の範囲内であり、室温保存における3年間の安定性が確認された。
包装
エバスチン錠5mg「NS」
(PTP包装)100錠
**エバスチン錠10mg「NS」
(PTP包装)100錠、1000錠
主要文献及び文献請求先
主要文献
1
日新製薬株式会社 社内資料:生物学的同等性に関する資料
2
**第十七改正日本薬局方解説書,C-938,廣川書店(2016)
3
日新製薬株式会社 社内資料:安定性に関する資料
文献請求先
主要文献に記載の社内資料につきましても下記にご請求下さい。
日新製薬株式会社 安全管理部
〒994−0069 山形県天童市清池東二丁目3番1号
TEL 023-655-2131 FAX 023-655-3419
E-mail:d-info@yg-nissin.co.jp
製造販売業者等の氏名又は名称及び住所
製造販売元
日新製薬株式会社
山形県天童市清池東二丁目3番1号